学年第二学期期末高二化学理科试题Word下载.docx
《学年第二学期期末高二化学理科试题Word下载.docx》由会员分享,可在线阅读,更多相关《学年第二学期期末高二化学理科试题Word下载.docx(9页珍藏版)》请在冰点文库上搜索。
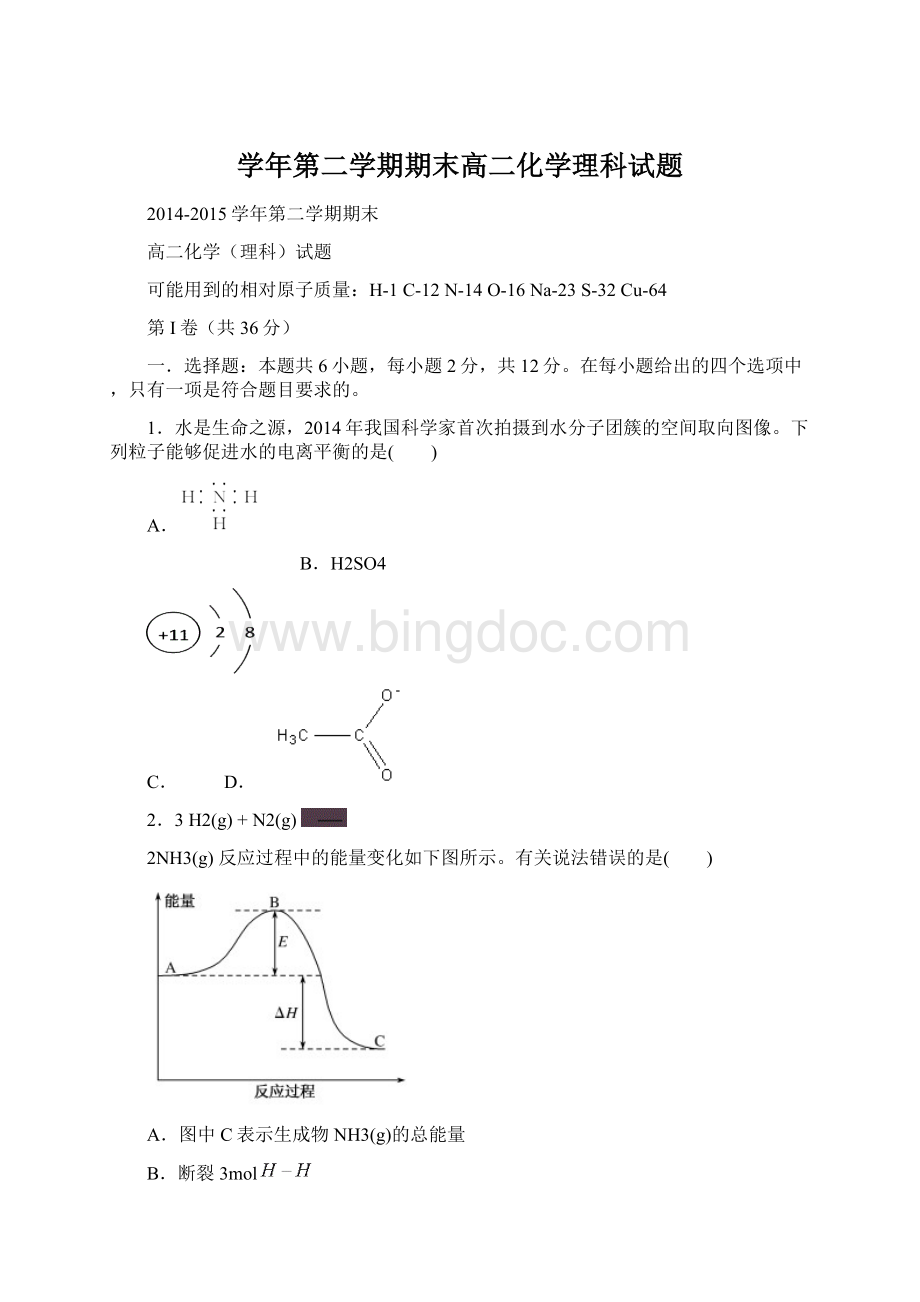
C.逆反应的活化能
D.3H2(g)+N2(g)
2NH3(g)△H<0
3.将BaO2放入密闭真空容器中,反应
达到平衡,保持温度不变,缩小容器容积,体系重新达到平衡,下列说法正确的是()
A、氧气压强不变B、BaO质量增加
C、BaO2质量不变D、平衡常数
,且保持不变
4.下列说法中正确的是()
A.强电解质溶液的导电能力一定比弱电解质溶液强
B.中和等pH等体积的氨水和NaOH溶液,氨水所需盐酸的物质的量多于NaOH溶液
C.pH相同的FeCl3溶液和HCl溶液,水电离出来的c(H+)相同
D.物质的量浓度相同的磷酸钠溶液和磷酸溶液中所含的c(
)相同
5.化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( )
A.Al2(SO4)3溶液呈酸性的原因是Al3+水解,离子方程式为:
Al3++3OH-
Al(OH)3
B.以KOH溶液为电解质溶液的氢氧燃料电池的负极反应式:
O2+2H2O+4e-===4OH-
C.测0.1mol/L氨水的pH为11:
NH3·
H2O
NH4++OH-
D.钢铁发生吸氧腐蚀的正极反应式:
Fe-2e-===Fe2+
6.将a、b、c、d4种金属两两连接浸入电解质溶液中,组成4个原电池(如图):
①中a极发生氧化反应 ②中电流由b到c ③中c极质量增加 ④中a极有大量气泡,则4种金属的活泼性由强到弱的顺序为( )21·
cn·
jy·
com
A.d>a>c>bB.b>d>c>aC.d>c>a>bD.a>d>b>c
二.选择题:
本题共6小题,每小题4分,共24分。
每小题有一个或两个选项符合题意。
若正确答案只包括一个选项,多选得0分;
若正确答案包括两个选项,只选一个且正确得2分,选两个且都正确得4分,但只要选错一个就得0分。
7.已知:
C(s)+O2(g)=CO2(g)△H1
O2(g)+2C(s)=2CO(g)△H2
2H2(g)+O2(g)=2H2O(g)△H3
CO(g)+H2O(g)=CO2(g)+H2(g)△H4
下列关于上述反应焓变的判断正确的是( )
A.△H2>0B.一氧化碳的燃烧热
C.氢气的燃烧热
D.
8.四个电解装置都以Pt作电极,它们分别盛装如下电解质溶液进行电解,电解一段时间后,测定其pH变化,所记录结果正确的是( )
A
B
C
D
电解质溶液
HBr
AgNO3
BaCl2
KOH
pH变化
变小
变大
不变
9.25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是( )
A.0.2mol/LCH3COONa与0.1mol/LHCl溶液等体积混合(pH<7):
c(Na+)>c(CH3COO-)>c(Cl-)>c(H+)>c(OH-)
B.0.1mol/LNH4Cl与0.1mol/L氨水等体积混合(pH>7):
c(NH3·
H2O)>c(NH4+)>c(Cl-)>c(OH-)>c(H+)
C.0.1mol/LNa2C2O4与0.1mol/LHCl溶液等体积混合(H2C2O4为二元弱酸):
2c(C2O42-)+c(HC2O4-)+c(OH-)=c(Na+)+c(H+)
D.0.1mol/LNa2CO3与0.2mol/LNaHCO3溶液等体积混合:
3c(Na+)=4[c(CO32-)+c(HCO3-)+c(H2CO3)]
10.右图是在航天用高压氢镍电池基础上发展起来的一种金属氢化物镍电池(MH-Ni电池)。
下列有关说法不正确的是( )
A.放电时正极反应为:
NiOOH+H2O+e-==Ni(OH)2+OH-
B.电池的电解液可为稀H2SO4溶液
C.充电时负极反应为:
MH+OH-—e-==H2O+M
D.MH是一类储氢材料,其所含氢密度越大,电池的能量密度越高
11.25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
A.pH=1的溶液中:
Na+、K+、MnO4-、C2O42-
B.0.1mol/LFeCl3溶液中:
Mg2+、NH4+、SCN-、SO42-
C.0.1mol/LNH4HCO3溶液中:
K+、Na+、NO3-、Cl-
D.水电离出来的c(H+)=1×
10-13mol/L的溶液中:
Fe2+、Cu2+、SO42-、NO3-
12.向饱和澄清石灰水中加入少量CaC2(实验室常用CaC2制乙炔),充分反应后恢复到原来的温度,所得溶液中( )
A.
增大
B.
均保持不变
C.氢氧化钙的溶解度增大D.
增大、
减小
第II卷(共64分)
13.(8分)某学生利用下面实验装置探究盐桥式原电池的工作原理。
按照实验步骤依次回答下列问题:
(1)导线中电子流向为__________(用a、b表示);
(2)写出装置中镀锌电极上的电极反应式:
_______________;
(3)若装置中铜电极的质量增加1.28g,则导线中转移的电子数目为__________;
(4)装置中盐桥中除添加琼脂外,还要添加KCl的饱和溶液,电池工作时,对盐桥中的
K+、Cl-的移动方向向表述正确的是__________。
A.盐桥中的K+向左侧烧杯移动、Cl-向右烧杯移动
B.盐桥中的K+向右侧烧杯移动、Cl-向左烧杯移动
C.盐桥中的K+、Cl-都向左侧烧杯移动
D.盐桥中的K+、Cl-几乎不移动
14.(8分)次磷酸(H3PO2),其结构式为
,是一种精细化工产品,是一元中强酸,具有较强还原性。
回答下列问题:
(1)NaH2PO2是正盐还是酸式盐?
(2)写出H3PO2电离平衡常数
的数学表达式(并注明单位):
(3)利用H3PO2和AgNO3溶液反应进行化学镀银,此反应中氧化剂与还原剂的物质的量之比为4︰1,写出其离子反应方程式:
15.(10分)目前国内外使用的融雪剂一般有两大类:
一类是以醋酸钾为主要成分的有机融雪剂;
另一类是以“氯盐”为主要成分的无机融雪剂,如氯化钠、氯化钙、氯化镁等,通称“化冰盐”。
某研究性学习小组拟对融雪氯盐(主要含有氯化钠及不溶性杂质、Mg2+、Ca2+等)进行回收提纯研究。
化学式
CaCO3
CaSO3
CaC2O4
Mg(OH)2
Ksp
2.8×
10-9
6.8×
10-8
4.0×
1.8×
10-11
该小组设计流程如图:
(1)加入混合液A的主要成分是________________(填化学式)。
(2)为检验溶液B中的Mg2+、Ca2+,通常分别取少量溶液B于两支试管中,进行如下实验:
步骤一:
检验Mg2+,向其中一支试管中加入________溶液(填化学式),看是否有沉淀生成。
步骤二:
检验Ca2+,向另一支试管中加入某溶液,看是否有沉淀生成。
下列三种溶液,其沉淀效果最好的是________。
A.0.1mol·
L-1Na2CO3溶液B.0.1mol·
L-1Na2SO3溶液C.0.1mol·
L-1Na2C2O4溶液
(3)在除杂过程中,常温下向粗盐悬浊液中加混合液A时需控制溶液pH=12以确保Mg2+除尽,根据提供的数据计算,溶液B中Mg2+物质的量浓度将被控制在________________以下。
(4)对溶液B加热并不断滴加6mol·
L-1的盐酸,同时用pH试纸检测溶液,直至pH=2时停止加盐酸,得到溶液C。
该操作的目的是_________________________________________。
(5)溶液C倒入蒸发皿中,加热蒸发并用玻璃棒不断搅拌,直到有大量固体析出时停止加热。
16.(8分)电解原理在化学工业中有广泛应用。
右图中甲、乙为相互串联的两电解池。
请回答:
(1)已知甲池中盛有500mL饱和食盐水,并事先滴有酚酞,A、B为石墨电极。
电解一段时间后,观察到B极附近变为红色,则该极上发生反应的电极反应式是;
检验A极产物的方法是。
a为直流电源的(填“正”或“负”)极。
(2)乙池为电解原理精炼铜的装置,则纯铜应作为(填“C”或“D”)极材料。
若乙池中的阴极增重1.60g时,甲池溶液的pH=(设甲池中溶液体积不变)。
17.(8分)已知水在25℃和95℃时,其电离平衡曲线如图所示:
(1)则95℃时水的电离平衡曲线应为__________(填“A”或“B”),请说明理由_________________________________________。
(2)25℃时,将pH=10的NaOH溶液与pH=5的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为______。
(3)95℃时,若1体积pH1=x的某强酸溶液与100体积pH2=y的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是__________。
(填关于x和y的关系式)
(4)曲线B对应温度下,pH=2的HA溶液和pH=10的某KOH溶液等体积混合后,混合溶液的pH=5。
请分析其原因:
________。
18.(10分)磷酸铁(FePO4·
2H2O,难溶于水的米白色固体)可用于生成药物、食品添加剂和锂离子电池的正极材料,实验室可通过下列实验制备磷酸铁。
称取一定量已除去油污的废铁屑,加入稍过量的稀硫酸,加热、搅拌,反应一段时间后过滤,反应加热的目的是。
(2)向滤液中加入一定量H2O2氧化Fe2+。
为确定加入H2O2的量,需先用KMnO4标准溶液滴定滤液中的Fe2+:
写出H2O2氧化Fe2+的离子方程式:
②在向(填酸式或碱式)滴定管注入KMnO4标准溶液前,滴定管需要检漏、水洗和润洗。
若滴定vmL滤液中的Fe2+,消耗amol·
L—1KMnO4标准溶液bmL,
则滤液中c(Fe2+)=mol·
L—1
④为使滤液中的Fe2+完全被H2O2氧化,下列实验条件控制正确的是(填序号)。
A、加入适当过量的H2O2溶液B、缓慢滴加H2O2溶液并搅拌
C、加热,使反应在较高温度下进行D、用氨水调节pH=7
19.(12分)化合物PCl3和单质Cl2在一定条件下反应可生成化合物PCl5。
(1)已知PCl3的熔点和沸点分别为-93.6℃和76.1℃,PCl5的熔点为167℃。
室温时2molPCl3与气体Cl2完全反应生成PCl5,放出热量257.6kJ。
该反应的热化学方程式为。
(2)反应PCl3(g)+Cl2(g)
PCl5(g)在容积为10L的密闭容器中进行。
起始时PCl3和Cl2均为0.2mol。
反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
①计算实验a从反应开始至达到平衡时的反应速率
=。
②图中3组实验从反应开始至达到平衡时的反应速率
由大到小的次序为(填实验序号);
与实验a相比,其他两组改变的实验条件及判断依据是:
b、
c。
③
、
分别表示实验a、b和cPCl5(g)的平衡转化率,比较其相对大小:
。