高一化学必修1第一章导学案全章文档格式.docx
《高一化学必修1第一章导学案全章文档格式.docx》由会员分享,可在线阅读,更多相关《高一化学必修1第一章导学案全章文档格式.docx(34页珍藏版)》请在冰点文库上搜索。
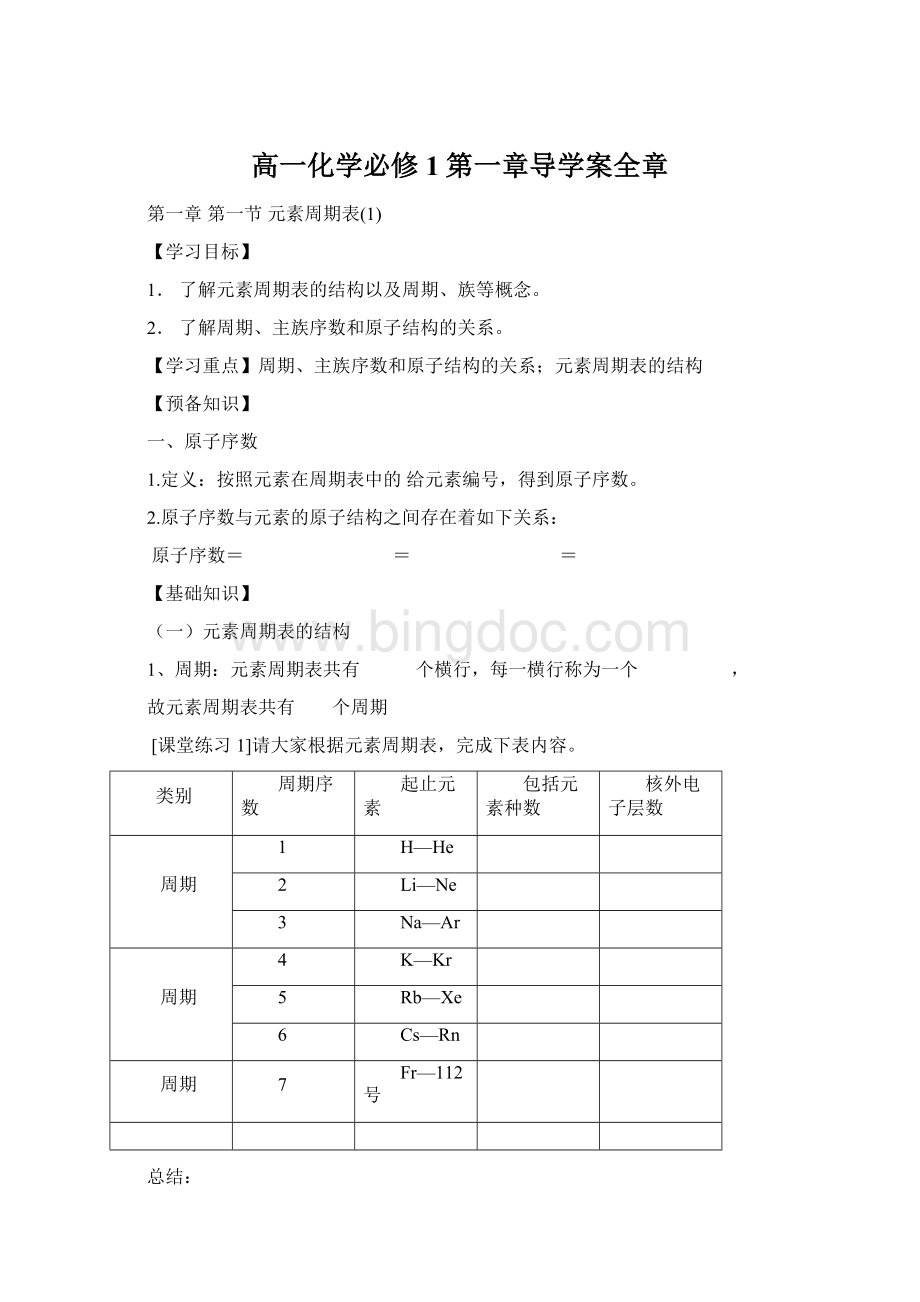
a、主族:
由元素和元素共同构成的族,
用A表示:
ⅠA、ⅡA、ⅢA、ⅣA、ⅤA、ⅥA、ⅦA
b、副族:
完全由元素构成的族,用B表示:
ⅠB、ⅡB、ⅢB、ⅣB、ⅤB、ⅥB、ⅦB
c、第Ⅷ族:
三个纵行
d、零族:
第纵行,即稀有气体元素
②主族序数与最外层电子数的关系:
③族的别称
ⅠA称为元素ⅦA称为元素
零族称为元素
[归纳小结]:
短周期(第周期)
周期:
个(共个横行) 长周期(第周期)
周期表 主族个:
ⅠA-ⅦA
族:
个(共个纵行)副族个:
IB-ⅦB
第Ⅷ族个(3个纵行)
族1个(稀有气体元素)
[课堂练习2]请描述出Na、C、Al、S在周期表中的位置。
[课堂练习3]某元素位于第二周期,第ⅦA族它是___元素。
P相邻的同族元素的原子序数是
【过关检测】
1.19世纪中叶,门捷列夫的突出贡献是( )
A.提出原子学说B.提出分子学说C.发现元素周期律D.提出电离学说
2.在短周期元素中,原子最外电子层只有1个或2个电子的元素是( )
A.金属元素B.稀有气体元素C.非金属元素D.无法确定为哪一类元
3、元素周期表是一座开放的“元素大厦”,元素大厦尚未客满。
请你在元素大厦中为119号元素安排好它的房间()
A.第八周期第IA族B.第七周期第ⅦA族
C.第七周期第0族D.第六周期第ⅡA族
4.下列各组中的元素用原子序数表示,其中都属于主族的一组元素是()
A.14号、24号、34号 B.26号、31号、35号
C.13号、20号、31号 D.11号、17号、18号
5.有短周期元素A、B、C,其中A、B同周期,B、C同主族,且最外层电子数之和为17,核电荷数之和为31,则A、B、C为()
A.C、N、SiB.N、P、OC.N、O、SD.C、Si、S
6、周期表中特殊位置的元素
1.族序数等于周期数的元素:
;
2.族序数等于周期数2倍的元素:
3.族序数等于周期数3倍的元素:
4.周期数是族序数2倍的元素:
5.周期数是族序数3倍的元素是:
7、第三周期第IVA族的元素原子序数是:
Na元素的原子序数为11,相邻的同族元素的原子序数是:
短周期元素中,族序数=周期序数的元素有:
族序数等于周期序数2倍的元素有:
周期序数=族序数2倍的有:
8、短周期元素X、Y、Z在周期表中的位置关系如右图所示,据此回答下列问题:
(1)X元素形成单质的分子式是__________;
(2)写出Y元素形成的单质跟水反应的化学方程式:
_____________;
(3)写出单质Z与钠反应的化学方程式:
_________________。
第一章第一节元素周期表
(2)
1.了解原子结构与元素性质的关系。
2.初步学会总结元素递变规律的能力。
【学习重点】元素性质的递变规律与元素组成微粒结构的联系
请同学们画出碱金属的原子结构示意图,分析碱金属原子结构的共同之处。
元素名称
核电荷数
原子结构示意图
最外层电子数
电子层数
碱
金
属
元
素
归纳:
1、原子结构
相似性:
最外层电子数相同,都为个
递变性:
从上到下,随着核电核数的,电子层数
原子半径。
2、单质的物理性质:
阅读课本P7第二自然段和表1-1,请总结碱金属物理性质有什么共性、递变性?
LiNaKRbCs
相似性
颜色、状态
熔沸点
硬度、密度
导电、导热性
递变性
密度变化
熔沸点变化
[思考与交流]我们知道物质的性质主要取决于原子的最外层电子数,从碱金属原子的结构可推知其化学性质如何?
是否完全相同?
[实验1]将一干燥的坩埚加热,同时取一小块钾,擦干表面的煤油后,迅速的投入到热坩埚中,观察现象。
同钠与氧气的反应比较。
[实验2]在培养皿中放入一些水,然后取绿豆大的钾,吸干表面的煤油,投入到培养皿中,观察现象。
同钠与水的反应进比较。
钠
钾
与氧气的反应
与水的反应
二、元素的性质与原子结构
3、碱金属的化学性质
1、与非金属的反应
Li+O2Na+O2K+O2
K、Rb等碱金属与O2反应,会生成超氧化物。
Rb、Cs在室温时,遇到空气会立即燃烧。
2、与水的反应
K+H2ORb+H2O
除Na、K外,其他碱金属元素也都可以和水反应生成相应的碱与H2。
[小结]2M+2H2O==2MOH+H2↑碱性:
[课堂练习1]:
钫(Fr)具有放射性,它是碱金属元素中最重的元素,下列预言错误的是:
A.在碱金属中它具有最大的原子半径B.它的氢氧化物化学式为FrOH,是一种极强的碱
C.钫在空气中燃烧时,只生成化学式为Fr2O的氧化物
D.它能跟水反应生成相应的碱和氢气,由于反应剧烈而发生爆炸
一、原子结构
相似性:
[阅读教材]第7、8页典型的非金属-----卤素看看他们的性质有原子结构间是否存在联系?
(二)卤素单质的物理性质(见课本第8页)
[思考与交流]请大家根据卤素单质的物理性质,总结出卤素单质在颜色、状态、密度、熔沸点、溶解性等各方面的递变规律。
[归纳与整理]
颜色:
状态:
密度:
熔沸点:
(三)卤素的化学性质:
1、卤素单质与氢气的反应(见课本第8页)
卤素和H2的反应可用通式H2+X2====来表示,反应时按F2、Cl2、Br2、I2的顺序,反应条件越来越,反应程度依次,形成的卤化氢的稳定性也依次。
[实验1]将少量新制的饱和氯水分别注盛有NaBr溶液和KI溶液的试管中,用力振荡后,在注入少量四氯化碳,振荡。
观察四氯化碳层和水层的颜色变化。
[实验2]将少量的溴水注入盛有KI溶液的试管中,用力振荡后,在注入少量的四氯化碳。
观察四氯化碳层和水层颜色的变化。
1、卤素单质间相互置换反应:
Cl2+NaBr=====Cl2+Br-=====
Cl2+KI=====Cl2+I-=====
[小结]卤素单质随着原子核电荷数的递增,在物理性质和化学性质方面,均表现出一定的相似性和递变性。
[归纳与总结]同一主族元素性质具有一定的相似性和递变性;
同一主族,从上到下:
原子半径逐渐增大,失电子能力逐渐,得电子能力逐渐,金属性逐渐,非金属性逐渐;
[课堂练习2]:
砹(At)是卤族元素中位于碘后面的元素,试推测砹和砹的化合物最不可能具备性质
A.砹易溶于某些有机溶剂B.砹化氢很稳定不易分解
C.砹是有色气体D.砹化银不溶于水或稀HNO3
元素金属性强弱:
1
2
3
元素非金属性强弱:
4
1、元素的半径主要取决于(),元素的化学性质主要取决于该元素原子的()
A.电子数B最外层电子数C质子数D电子层数
2、砹(At)是原子序数最大的卤素元素,推测砹和砹的化合物最不可能具有的性质是:
()
A、砹化氢(HAt)很稳定B、单质砹易溶于某些有机溶剂
C、砹的原子半径比碘的原子半径大D、砹的单质是有色固体
3、碱金属钫(Fr)具有放射性,它是碱金属元素中最重的元素,下列预言错误的是:
A.在碱金属中它具有最大的原子半径
B.它的氢氧化物化学式为FrOH,是一种极强的碱
C.钫在空气中燃烧时,只生成化学式为Fr2O的氧化物
D.它能跟水反应生成相应的碱和氢气,由于反应剧烈而发生爆炸.
4、下列关于卤素的叙述正确的是()
A、卤素有单质存在于自然界中
B、随核电荷数增加,单质熔沸点升高
C、随核电荷数增加,单质氧化性增强
D、单质与水反应,均可用通式X2+H2O=HX+HXO表示
5、关于碱金属单质的性质叙述错误的是()
A.在空气中燃烧的生成物都是过氧化物
B.与盐溶液反应时都能生成碱和氢气
C.熔沸点随原子序数增加而降低
D.还原性随原子电子层数的增加而增加
6、已知钡的活动性处于钾和钠之间,则下述说法中可能实现的是()
A.钡可从氯化钾溶液中置换出钾
B.钡可从冷水中置换出氢气
C.钡可从氯化钠溶液中置换出钠
D.在溶液中钡离子可氧化金属锌,使之成为锌离子
7.鉴别Cl-、Br-、I-可以选用的试剂是()
A.碘水,淀粉溶液B.氯水,四氯化碳
C.淀粉,KI溶液D.硝酸银溶液,稀HNO3
8、在下列各元素组中,除一种元素外,其余都可以按某种共性归属一类,请选出各组的例外元素,并将该组其他元素的可能归属,按所给六种类型的编号填入表内。
元素组
例外元素
其他元素所属类型编号
S、N、Na、Mg
P、Sb、Sn、As
Rb、B、Te、Fe
归属类型:
(1)主族元素
(2)过渡元素(3)同周期元素(4)同族元素(5)金属元素(6)非金属元素
第一章第一节元素周期表(3)
1.了解原子结构与同位素、使学生懂得质量数和AZX的含义。
2.初步学会元素周期表的位置与元素组成微粒的结构联系起来运用能力。
【学习重点】同位素、质量数和AZX的含义
原子的构成:
原子
看表分析:
质量/kg
相对质量
电性和电量/C
质子
1.673×
10-27
1.007
+1.602×
10-19
中子
1.675×
1.008
电子
9.109×
10-31
1/1836
-1.602×
总结:
原子是由居于原子中心的带正电的和核外带负电的构成的。
原子核由和构成。
原子的质量主要集中在上。
(一)质量数
定义
符号:
计算式:
质量数(A)=+
应用:
用质量数表示某种原子
[思考]:
它表示的含义是什么?
[科学探究]:
1、填写下表,总结A与相对原子质量的关系。
原子
质子数
(Z)
中子数
(N)
质子数+中子数
(A)
相对原子质量
F
10
18.998
Na
12
22.990
Al
14
26.982
2、原子形成离子之后构成原子的微粒哪些发生了变化?
如何改变?
质量数呢?
[总结和比较]:
和
中的质子数、中子数、质量数和电子数。
[课堂练习1]:
1、完成表格1
符号
质量数
电子数
20
40
18
2、完成表2
元素符号
原子符号
8
(二)核素和同位素
核素:
同位素:
[思考与交流]:
1、元素、核素、同位素的不同和联系。
在周期表中收入了112种元素,是不是就只有112种原子呢?
2、Cl元素有两种天然同位素
、
。
⑴在形成的Cl2分子中,会有种不同的分子,它的相对分子质量分别为
、。
⑵从原子的组成看,原子的质量数均为整数,但氯元素的相对原子质量却是35.5,这是为什么?
1、有以下一些微粒:
①
②
③
④
⑤
其中互为同位素的是和
质量数相等但不能互为同位素的是和
中子数相等,但质子数不等的是和、和。
2、下列各组中属于同位素的是()
A、40K与40CaB、T2O和H2OC、40K与39KD、金刚石与石墨
一、选择题
1、元素的种类和原子的种类()
A.前者大B.后者大C.相同D.无法确定
2、下列各组粒子属于同位素的是()
A.
Cl和
ClB.
K和
CaC.O2和O3D.H2O和D2O
3、某微粒用
n+表示,下列关于该微粒的叙述中正确的是
A所含质子数=A-nB所含中子数=A-Z
C所含电子数=Z+nD质子数=Z+A
4、11H、21H、31H、H+、H2是
A氢的五种同位素B.五种氢元素
C氢的五种同素异形体D.氢元素的五种不同微粒
5、据最新报道,放射性同位素钬16667Ho可有效地治疗肝癌。
该同位素原子核内的中子数与核外电子数之差是
A32B67C99D166
6、钛(Ti)金属常被称为未来钢铁。
钛元素的同位素
中,中子数不可能为
A30B28C26D24
7、据报道,上海某医院正在研究用放射性同位素碘12553I治疗肿瘤。
该同位素原于核内的中子数与核外电子数之差是
A72B19C53D125
8、据报道,某些建筑材料会产生放射性同位素氡22286Rn,从而对人体产生伤害。
该同位素原子的中子数和质子数之差是
A136B50C86D222
9、已知自然界氧的同位素有16O、17O、18O,氢的同位素有H、D,从水分子的原子组成来看,自然界的水一共有
A.3种B.6种C.9种D.12种
二、填空题:
10.用符号A:
质子数;
B:
中子数;
C:
核外电子数;
D:
最外层电子数;
E:
电子层数,填写下列各空:
(1)原子种类由 决定;
(2)元素种类由 决定;
(3)核电荷数由 决定;
(4)元素的化学性质主要由 决定;
(5)元素的原子半径由 决定;
(6)元素的化合价主要由 决定;
11.将某文献资料上记载的相对原子质量数据摘录如下:
35Cl
34.969
75.77%
35
37Cl
36.966
24.23%
37
平均
35.453
35.485
试回答下列问题:
(1)34.969是表示_______________;
(2)35.453是表示_______________;
(3)35是表示____________________;
(4)35.485是表示____________________;
(5)24.23是表示_______________________。
12.下列各组粒子,属于同一种原子的是,互为同位素的是,属于同种元素的是,属于同素异形体的是。
(填编号)
A.红磷、白磷B.核外电子数是10的甲乙两种粒子
C.
(核内15个中子)D.
E.中子数相同的甲乙两种粒子
13.对于
,按下列要求各举一例(即每小题分别写出符号题意的两种粒子)。
(1)Z相同而A不同。
(2)A相同而Z不同。
(3)A、Z相同而n不同。
(4)A、Z、n相同而b不同。
第一章第二节元素周期律
(1)
【学习目标】1、了解原子核外电子的排布;
2、掌握元素化合价随原子序数的递增而呈现出的周期性变化规律;
3、微粒半径及大小的比较。
【学习重点】元素化合价,原子半径随原子序数的递增的变化规律,原子及微粒半径大小比较
一、原子核外电子的排布:
1.原子核外的电子由于能量不同,它们运动的区域也不同。
通常能量低的电子在离核____的区域运动,能量高的电子在离核____的区域运动。
2.表示方法
电子层(n)
对应符号
3.排布规律
⑴按能量由低到高,即由内到外,分层排布。
1第1层最多只能排____个电子
2②第2层最多排____个电子
3③除K层外,不论原子有几个电子层,其最外层中的电子数最多只能有____个(K层最多有____个)
⑵根据核外电子排布的规律,能划出1-20号原子结构示意图。
二、化合价的周期性变化
[科学探究1]标出1—18号元素的化合价,找出规律。
原子序数
最高正价或最低负价的变化
1~2
+1
3~10
+1+4+5
-4-1
11~18
+1+4+5+7
结论:
随着原子序数的递增,元素也呈现周期性变化。
三、原子半径的递变规律
H
He
原子半径nm
0.037
Li
Be
B
C
N
O
Ne
0.152
0.089
0.082
0.077
0.075
0.074
0.071
Mg
Si
P
S
Cl
Ar
0.186
0.160
0.143
0.117
0.110
0.102
0.099
同一周期,随着原子序数的递增,元素原子半径逐渐,呈现周期性变化。
四、微粒半径大小的比较
1、原子半径大小的比较
同主族,从上到下,原子半径逐渐。
同周期,从左到右,原子半径逐渐。
2、离子半径大小的比较
(1)具有相同电子层结构的离子半径大小的比较
电子层数相同,随核电荷数增加,原子核对核外电子吸引能力,半径。
(2)同主族离子半径大小的比较
元素周期表中从上到下,电子层数逐渐,离子半径逐渐。
(3)同一元素的不同离子的半径大小比较
同种元素的各微粒,核外电子数越多,半径,高价阳离子半径低价离子半径。
【自主探究】
根据下列原子结构示意图回答(用编号回答):
①②③④
⑴半径最小的是________⑵具有最低负化合价的是___________
⑶只有还原性的是______⑷只有氧化性的是_______
【探求新知】
一、原子核外电子的排布
1、电子的特征:
电子的运动具有区别于宏观物体的几大特征:
(1)质量很____(9.109×
10-31kg);
(2)带_____电荷;
(3)运动空间范围_____(直径约10-10m);
(4)运动速度_______。
因此,电子的运动特征就与宏观物体的运动有着极大的不同一一它没有确定的轨道。
2、核外电子的排布规律
(1).电子是在原子核外距核由___及____、能量由___至____的不同电子层上分层排布;
(2).每层最多容纳的电子数为______(n代表电子层数);
(3).电子一般总是尽先排在能量最____的电子层里,即最先排第_____层,当第___层排满后,再排第____层,等等。
(4).最外层电子数则不超过_____个(第一层为最外层时,电子数不超过_____个)。
3、电子的能量高低与离核远近的关系:
电子层1234n
电子层符号KLMN……
离核距离近远
电子的能量()()
最多能容纳的电子数2818322n2
4、对原子最外层电子数随原子序数变化情况,能得出什么结论?
【结论】随着原子序数的递增,_____________________________________________。
对于元素主要化合价的变化,你的结论是什么?
【结论】随着原子序数的递增,____________________________________________。
且有以下量的关系:
│最高正价│+│负价│=___________
对于原子半径的变化,你的结论是什么?
且有规律:
电子层数相同的元素的原子随原子序数的增加,半径逐渐________。
影响原子半径的因素:
(1)电子层数相同时,影响原子半径的因素是什么?
(2)最外层电子数相同时,其影响因素是什么?
【结论】影响原子半径的因素:
电子层数相同,质子数越多,吸引力越大,半径越____;
最外层电子数相同,电子层数越多,电子数越多,半径越_____。
【自主探究】根据1—18号元素的原子结构示意图,体会元素性质和原子结构的关系。
______________________________________________________________________
【迁移与应用】
1.下列微粒结构示意图表示的各是什么微粒?
2.下列微粒结构示意图是否正确?
如有错误,指出错误的原因。
3.现有
微粒结构示意图,试填表,当n取不同值时相对应的微粒名称和微粒符号。
n值