高三理综化学实验2.docx
《高三理综化学实验2.docx》由会员分享,可在线阅读,更多相关《高三理综化学实验2.docx(79页珍藏版)》请在冰点文库上搜索。
高三理综化学实验2
2014年4月新锐教育的高中化学组卷
一.填空题(共10小题)
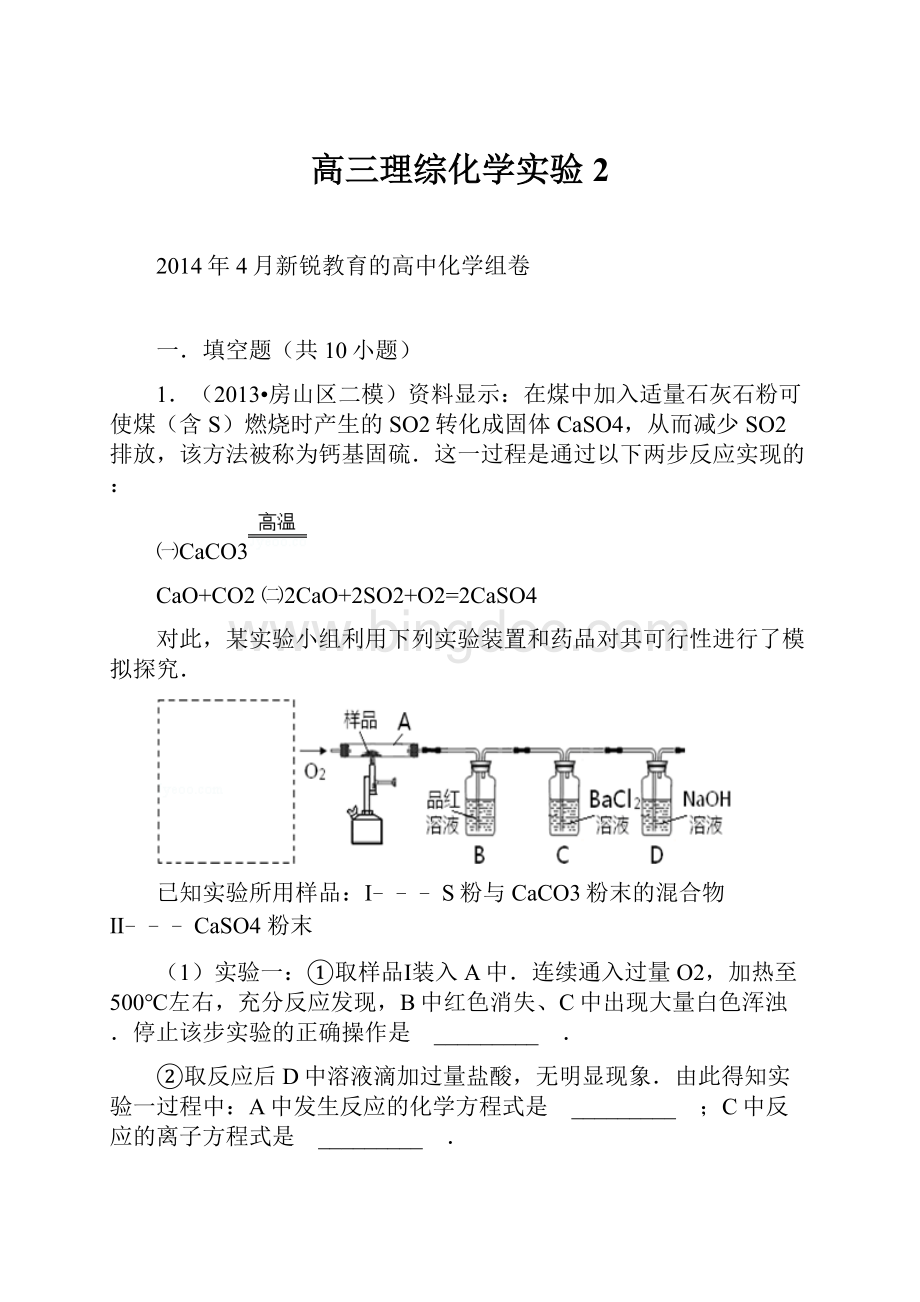
1.(2013•房山区二模)资料显示:
在煤中加入适量石灰石粉可使煤(含S)燃烧时产生的SO2转化成固体CaSO4,从而减少SO2排放,该方法被称为钙基固硫.这一过程是通过以下两步反应实现的:
㈠CaCO3
CaO+CO2㈡2CaO+2SO2+O2=2CaSO4
对此,某实验小组利用下列实验装置和药品对其可行性进行了模拟探究.
已知实验所用样品:
Ⅰ﹣﹣﹣S粉与CaCO3粉末的混合物Ⅱ﹣﹣﹣CaSO4粉末
(1)实验一:
①取样品Ⅰ装入A中.连续通入过量O2,加热至500℃左右,充分反应发现,B中红色消失、C中出现大量白色浑浊.停止该步实验的正确操作是 _________ .
②取反应后D中溶液滴加过量盐酸,无明显现象.由此得知实验一过程中:
A中发生反应的化学方程式是 _________ ;C中反应的离子方程式是 _________ .
③要获得与以上实验事实相一致的结论,可替代B中品红溶液的是 _________ .
a.酚酞的NH3•H2O溶液b.酸性KMnO4溶液
c.酚酞的NaHCO3溶液d.Br2的CCl4溶液
(2)实验二:
①取样品Ⅰ装入A中.连续通入过量O2,并迅速加热升温,控制在1000℃左右,充分反应.发现B中红色消失,C中出现白色浑浊.
②取反应后D中溶液滴加过量盐酸,出现大量无色气泡,反应的离子方程式是 _________ .
③反应结束后,将A中余下固体溶入水中,取其上层清液,滴加BaCl2溶液,立即有白色沉淀出现.
由此得知实验二:
A中发生的反应有 _________ (填选“㈠”、“㈡”).
(3)实验三:
取样品Ⅱ装入A中.连续通入过量O2,加热至1200℃左右,充分反应,B中红色消失,则A中发生反应的化学方程式是 _________ .比较实验一、二、三可知,如用该方法固硫,可行的基本条件是 _________ .
(4)在中学化学实验室里,装置A通常只能选 _________ 为材料制作的玻璃管,但这种选择有一点不妥,其理由用化学方程式解释是:
_________ .
(5)实验所需O2若改由空气提供,且对上述实验探究事实不产生影响,应在A前添加一装有某药品的装置.请将该药品和装置图示在图中的虚线框内 _________ .
2.(2013•房山区一模)某黄铜矿样品标注显示:
主要成分为CuFeS2(含81.5%),其余多为脉石(SiO2).为检验该黄铜矿的纯度是否与标注一致,设计了如下实验:
已知:
①在空气存在下煅烧黄铜矿,生成Cu、Fe3O4和SO2气体.②亚硫酸易被氧化:
2H2SO3+O2=2H2SO4
请回答下列问题:
(1)检验装置气密性后,称取研细的黄铜矿样品1.150g,放入硬质玻璃管中,研细的目的是 _________ .
(2)通入空气一段时间后,点燃酒精喷灯加热样品,充分反应,装置B、装置C中反应的化学方程式分别是 _________ 、 _________ .
(3)反应过程中,装置A的作用是 _________ (填序号).
①除去空气中的二氧化碳②除去空气中的水蒸气 ③使空气成分均匀混合④用于观察、控制空气流速
(4)反应结束前的操作是:
先撤掉酒精喷灯,再 _________ ,其目的是 _________ .
(5)取装置C中溶液的1/10置于锥形瓶中,用0.05mol•L﹣1标准碘溶液进行滴定,反应的离子方程式为 _________ ;判断滴定达到终点的现象是 _________ ;若滴定中消耗标准碘溶液20.00mL,则该黄铜矿的纯度测定结果比标注值 _________ (偏低或偏高),造成该结果的原因之一可能是 _________ ,改进的建议是 _________ .
3.(2013•西城区二模)某小组同学为探究H2O2、H2SO3、Br2氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验).
实验记录如下:
实验操作
实验现象
I
打开活塞a,滴加氯水,关闭活塞a
A中溶液变为红棕色.
II
吹入热空气
A中红棕色明显变浅;B中有气泡,产生大量白色沉淀,混合液颜色无明显变化.
III
停止吹入空气,打开活塞b,逐滴加入H2O2溶液
开始时颜色无明显变化;继续滴加H2O2溶液,一段时间后,混合液逐渐变成红棕色.
请回答下列问题:
(1)A中反应的离子方程式是 _________ .
(2)实验操作II吹入热空气的目的是 _________ .
(3)装置C的作用是 _________ ,C中盛放的药品是 _________ .
(4)实验操作III,混合液逐渐变成红棕色,其对应的离子方程式 _________ .
(5)由上述实验得出的结论是 _________ .
(6)实验反思:
①有同学认为实验操作II吹入的热空气,会干扰(5)中结论的得出,你认为是否干扰,理由是 _________ .
②实验操作III,开始时颜色无明显变化的原因是(写出一条即可):
_________ .
4.(2013•朝阳区二模)某实验小组把CO2通入饱和Na2CO3溶液制取NaHCO3,装置如图所示(气密性已检验,部分夹持装置略):
(1)D中产生NaHCO3的化学方程式是 _________ .
(2)请结合化学平衡移动原理解释B中溶液的作用 _________ .
(3)当D中有大量白色固体析出时,停止实验,将固体过滤、洗涤、干燥备用.为确定固体的成分,实验小组设计方案如下(称取一定质量的固体,配成1000mL溶液作为样液,其余固体备用):
①方案1:
取样液与澄清的Ca(OH)2溶液混合,出现白色沉淀.实验小组对现象产生的原理进行分析,认为该方案不合理,理由是 _________ .
②方案2:
取样液与BaCl2溶液混合,出现白色沉淀并有气体产生.实验小组认为固体中存在NaHCO3,其离子方程式是 _________ .该小组认为不能确定是否存在Na2CO3,你认为该结论是否合理?
_________ .
③方案3:
实验小组中甲、乙同学利用NaHCO3的不稳定性进行如下实验:
甲同学:
取样液400mL,用pH计测溶液pH,再水浴加热蒸发至200mL,接下来的操作是 _________ ,结果表明白色固体中存在NaHCO3.为进一步证明白色固体是否为纯净的NaHCO3,结合甲同学实验,还应补充的实验是 _________ .
乙同学:
利用仪器测定了固体残留率
随温度变化的曲线,如图所示.
a.根据A点坐标得到的结论是 _________ .
b.根据B点坐标,计算残留固体中n(NaHCO3):
n(Na2CO3)= _________ .
通过上述实验,该小组认为,可以向饱和Na2CO3溶液中通入过量CO2制备NaHCO3.
5.(2013•丰台区二模)某课外活动小组探究镁与CO2、NO2的反应
(1)实验发现点燃的镁条能在CO2气体中继续燃烧,产生黑、白两种固体,请用化学反应解释该现象 _________ .
(2)该小组采用类比Mg与CO2反应的思路对Mg与NO2的反应进行预测:
写出Mg与NO2反应的化学方程式 _________ .
(3)设计实验验证猜测(用于连接玻璃管的乳胶管均内衬锡纸)
资料信息:
2NO2+2NaOH=NaNO3+NaNO2+H2O
①装置A中的试剂是 _________ .
②干燥管和装置B的作用分别是 _________ 、 _________ .
③实验开始时正确的操作步骤是 _________ .
a.通入NO2
b.打开弹簧夹
c.点燃酒精灯
d.当硬质玻璃管充满红综色气体后,关闭弹簧夹
(4)实验结束时,同学们观察到与预测相符合的现象,但当用水洗涤硬质玻璃管时,固体遇水产生有刺激性气味的气体,该气体能使湿润的石蕊试纸变蓝.
①同学们认为硬质玻璃管中还发生了另一个反应,该反应为 _________ .
②请用化学方程式解释加水产生该气体的原因 _________ .
6.(2013•海淀区二模)硫化氢(H2S)是一种具有臭鸡蛋气味的无色气体,有剧毒;存在于多种生产过程以及自然界中.在人体的很多生理过程中也起着重要作用.
资料:
①H2S可溶于水(约1:
2),其水溶液为二元弱酸.
②H2S可与许多金属离子反应生成沉淀.
③H2S在空气中燃烧,火焰呈淡蓝色.
(1)某化学小组设计了制取H2S并验证其性质的实验,如下图所示.A中是CuSO4溶液,B中放有湿润的蓝色石蕊试纸,C中是FeCl3溶液.
回答下列问题:
①A中有黑色沉淀(CuS)产生,A中发生反应的化学方程式为 _________ .
②B中的现象是 _________ .
③C中只有浅黄色沉淀产生,且溶液变浅绿色.则C中发生反应的离子方程式为 _________ .
④D中盛放的试剂可以是 _________ (填标号).
a.水b.盐酸c.NaCl溶液d.NaOH溶液
(2)为进一步探究﹣2价硫的化合物与+4价硫的化合物反应条件,小组同学又设计了下列实验.
实验操作
实验现象
实验1
将等浓度的Na2S和Na2SO3溶液按体积比2:
1混合
无明显现象
实验2
将H2S通入Na2SO3溶液中
未见明显沉淀,再加入少量稀硫酸,立即产生大量浅黄色沉淀
实验3
将SO2通入Na2S溶液中
有浅黄色沉淀产生
已知:
电离平衡常数:
H2SKa1=1.3×10﹣7;Ka2=7.1×10﹣15
H2SO3Ka1=1.7×10﹣2;Ka2=5.6×10﹣8
①根据上述实验,可以得出结论:
在 _________ 条件下,+4价硫的化合物可以氧化﹣2价硫的化合物.
②将SO2气体通入H2S水溶液中直至过量,下列表示溶液pH随SO2气体体积变化关系示意图正确的是 _________ (填序号).
(3)文献记载,常温下H2S可与Ag发生置换反应生成H2.现将H2S气体通过装有银粉的玻璃管,请设计简单实验,通过检验反应产物证明H2S与Ag发生了置换反应 _________ .
7.(2013•西城区一模)甲、乙两同学用下图所示装置进行实验,探究硝酸与铁反应的产物.
文献记载:
I.在浓硝酸和活泼金属反应过程中,随着硝酸浓度的降低,其生成的产物有+4、+2、﹣3价等氮的化合物.
II.FeSO4+NO⇌Fe(NO)SO4(棕色)△H<0.
III.NO2和NO都能被KMnO4氧化吸收.
甲的实验操作和现象记录如下:
实验操作
实验现象
打开弹簧夹,通入一段时间CO2,关闭弹簧夹.
打开分液漏斗活塞,将浓硝酸缓慢滴入烧瓶中,关闭活塞.
无明显现象.
加热烧瓶,反应开始后停止加热.
①A中有红棕色气体产生,一段时间后,气体颜色逐渐变浅;B中溶液变棕色;C中溶液紫色变浅.
②反应停止后,A中无固体剩余.
请回答下列问题:
(1)滴入浓硝酸加热前没有明显现象的原因是 _________ .
(2)检验是否生成﹣3价氮的化合物,应进行的实验操作是 _________ .
(3)甲取少量B中溶液,加热,实验现象是 _________ .请用化学平衡原理解释原因:
_________ .甲依据该现象得出的结论是A中有NO生成.
(4)乙认为甲得出A中有NO生成的证据不足.为获取充足的证据,乙仍采用该装置和操作进行对照实验,乙作出的改变是 _________ ,证明有NO生成的实验现象是 _________ .
(5)证明A溶液中是否含有Fe2+和Fe3+,选择的药品是(填序号) _________ .
a.铁粉b.溴水c.鉄氰化钾溶液d.硫氰化钾溶液.
8.(2013•朝阳区一模)实验室制乙烯时,产生的气体能使Br2的四氯化碳溶液褪色,甲、乙同学用下列实验验证.(气密性已检验,部分夹持装置略).
实验操作和现象:
操作
现象
点燃酒精灯,
加热至170℃
Ⅰ:
A中烧瓶内液体渐渐变黑
Ⅱ:
B内气泡连续冒出,溶液逐渐褪色
…
实验完毕,
清洗烧瓶
Ⅲ:
A中烧瓶内附着少量黑色颗粒状物,有刺激性气味逸出
(1)烧瓶内产生乙烯的化学方程式是 _________
(2)溶液“渐渐变黑”,说明浓硫酸具有 _________ 性.
(3)分析使B中溶液褪色的物质,甲认为是C2H4,乙认为不能排除SO2的作用.
①根据甲的观点,使B中溶液褪色反应的化学方程式是 _________
②乙根据现象Ⅲ认为产生了SO2,在B中与SO2反应使溶液褪色的物质是 _________
③为证实各自观点,甲、乙重新实验,设计与现象如下:
设计
现象
甲
在A、B间增加一个装有某种试剂的洗气瓶
Br2的CCl4溶液褪色
乙
与A连接的装置如下:
D中溶液由红棕色变为浅红棕色时,E中溶液褪色
a.根据甲的设计,洗气瓶中盛放的试剂是 _________
b.根据乙的设计,C中盛放的试剂是 _________
c.能说明确实是SO2使E中溶液褪色的实验是 _________
d.乙为进一步验证其观点,取少量D中溶液,加入几滴BaCl2溶液,振荡,产生大量白色沉淀,浅红棕色消失,发生反应的离子方程式是 _________
(4)上述实验得到的结论是 _________ .
9.(2013•顺义区二模)亚硝酸钠是重要的防腐剂.某化学兴趣小组以碳和浓硝酸为起始原料,设计如下装置利用一氧化氮与过氧化钠反应制备亚硝酸钠.(夹持装置和A中加热装置已略,气密性已检验)
查阅资料:
①HNO2为弱酸,室温下存在反应3HNO2=HNO3+2NO↑+H2O;
②在酸性溶液中,NO2﹣可将MnO4﹣还原为Mn2+且无气体生成.
③NO不与碱反应,可被酸性KMnO4溶液氧化为硝酸
实验操作:
①关闭弹簧夹,打开A中分液漏斗活塞,滴加一定量浓硝酸,加热;
②一段时间后停止加热;
③从C中取少量固体,检验是否是亚硝酸钠.
(1)A中反应的化学方程式是 _________ .
(2)B中观察的主要现象是 _________ ,D装置的作用是 _________ .
(3)检验C中产物有亚硝酸钠的操作是 _________ .
(4)经检验C产物中亚硝酸钠含量较少.
a.甲同学认为C中产物不仅有亚硝酸钠,还有碳酸钠和氢氧化钠.生成碳酸钠的化学方程式是 _________ .为排除干扰甲在B、C装置间增加装置E,E中盛放的试剂应是 _________ (写名称).
b.乙同学认为除上述干扰因素外,还会有空气参与反应导致产品不纯,所以在实验操作①前应增加一步操作,该操作是 _________ .
(5)实验经改进后可制得较纯亚硝酸钠,下列关于亚硝酸钠的说法正确的是 _________ .
a.亚硝酸钠有咸味,可代替食盐食用
b.常温下,0.1mol/L亚硝酸溶液pH>1
c.0.1mol/L亚硝酸钠溶液中存在:
c(Na+)+c(H+)=c(NO2﹣)+c(OH﹣)
d.0.1mol/L亚硝酸钠溶液中存在:
c(NO2﹣)>c(Na+)>c(OH﹣)>c(H+)
10.(2013•江苏)氧化镁在医药、建筑等行业应用广泛.硫酸镁还原热解制备高纯氧化镁是一种新的探索.以菱镁矿(主要成分为MgCO3,含少量FeCO3)为原料制备高纯氧化镁的实验流程如下:
(1)MgCO3与稀硫酸反应的离子方程式为 _________ .
(2)加入H2O2氧化时,发生反应的化学方程式为 _________ .
(3)滤渣2的成分是 _________ (填化学式).
(4)煅烧过程存在以下反应:
2MgSO4+C
2MgO+2SO2↑+CO2↑
MgSO4+C
MgO+SO2↑+CO↑
MgSO4+3C
MgO+S↑+3CO↑
利用如图装置对煅烧产生的气体进行分步吸收或收集.
①D中收集的气体可以是 _________ (填化学式).
②B中盛放的溶液可以是 _________ (填字母).
a.NaOH溶液b.Na2CO3溶液c.稀硝酸d.KMnO4溶液
③A中得到的淡黄色固体与热的NaOH溶液反应,产物中元素最高价态为+4,写出该反应的离子方程式:
_________ .
二.解答题(共5小题)
11.(2013•东城区二模)某校兴趣小组用如图Ⅰ装置制取漂白液(气密性已检验,试剂已添加),并研究其相关性质.
实验操作和现象:
打开分液漏斗的活塞,缓缓滴加一定量浓盐酸,点燃酒精灯;一段时间后,关闭分液漏斗的活塞,熄灭酒精灯.
(1)烧瓶中反应的化学方程式是 _________ .
(2)饱和食盐水的作用是 _________ .
(3)若用图Ⅱ装置收集多余的氯气,请在虚线框内画出该装置简图.
(4)该小组同学用上述装置制得的漂白液中NaClO的浓度偏低.
查阅资料:
在溶液中发生反应:
(a)Cl2(g)+2NaOH(aq)═NaCl(aq)+NaClO(aq)+H2O(l)DH1=﹣101.1kJ/mol
(b)3NaClO(aq)═2NaCl(aq)+NaClO3(aq)DH2=﹣112.2kJ/mol
反应(a)的反应速率很快,反应(b)在室温下较慢,根据资料,请对图Ⅰ装置提出改进建议:
_________ .
(5)修改方案后,该小组同学制得了较高浓度的NaClO溶液.他们把漂白液和滴有酚酞的红色Na2SO3溶液混合后,得到无色溶液.
提出猜想:
ⅰ.NaClO把Na2SO3氧化了
ⅱ.NaClO把酚酞氧化了
ⅲ.NaClO把Na2SO3和酚酞均氧化了
①下列实验方案中可以证明NaClO氧化了Na2SO3的是 _________ .
a.向混合后的溶液中加入过量盐酸
b.向混合后的溶液中加入过量盐酸,再加入氯化钡溶液
c.向混合后的溶液中加入过量硝酸,再加入硝酸银溶液
d.向混合后的溶液中加入氢氧化钡溶液,再加入过量盐酸
②为证明NaClO氧化了酚酞,可进行的实验是 _________ .
12.(2013•通州区二模)如图是一个制取氯气并以氯气为原料进行特定反应的装置:
(几种气体的溶解度:
常温常压下,1体积水可溶解CO2、Cl2、HCl分别为1、2、500体积)
(1)A是氯气发生装置,其中的离子反应方程式为 _________ ;
(2)要将C装置接入B和D之间,正确的接法是a→ _________ , _________ →d.
(3)实验开始时,先点燃A处的酒精灯,打开旋塞K,让Cl2充满整个装置,再点燃D处酒精灯,连接上E装置.Cl2通过C瓶后再进入D.D装置的硬质玻璃管内盛有炭粉,发生氧化还原反应,其产物为两种气体,且体积比为1:
4.试写出D中发生反应的化学方程式 _________ ,装置C的作用是 _________ ;为了使C装置发挥更好的作用,可向烧杯中加入浓硫酸,加入浓硫酸的作用是 _________ .
(4)在A、B、C、D、E装置中有一处需要改进,说明需要改进的理由并画出改进后的装置图 _________ .
(5)D处反应完毕后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有Cl2产生,此时B中的现象是 _________ .
13.(2011•东城区二模)
(1)已知Na2S2O3+H2SO4=Na2SO4+S↓+SO2+H2O.甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响.设计实验如下(所取溶液体积均为10mL):
实验编号
实验温度/℃
c(Na2S2O3)/mol•L﹣1
c(H2SO4)/mol•L﹣1
①
25
0.1
0.1
②
25
0.1
0.2
③
50
0.2
0.1
④
50
0.1
0.1
其他条件不变时:
探究浓度对化学反应速率的影响,应选择 _________ (填实验编号);
探究温度对化学反应速率的影响,应选择 _________ (填实验编号).
(2)已知Na2S2O3溶液与Cl2反应时,1molNa2S2O3转移8mol电子.该反应的离子方程式是 _________ .
甲同学设计如下实验流程探究Na2S2O3的化学性质.
(Ⅰ)甲同学设计实验流程的目的是证明Na2S2O3溶液具有碱性和 _________ 性.
(Ⅱ)生成白色沉淀B的离子方程式是 _________ .
(Ⅲ)乙同学认为应将上述流程中②③所加试剂顺序颠倒,你认为甲、乙两同学的设计更合理的是 _________ (填“甲”或“乙”),理由是 _________ .
14.(2014•东城区一模)氯化铜是一种广泛用于生产颜料、木材防腐剂等的化工产品.某研究小组用粗铜(含杂质Fe)按下述流程制备氯化铜晶体
(CuCl2•2H2O).
(1)实验室采用如图所示的装置,可将粗铜与Cl2反应转化为固体1(部分仪器和夹持装置已略去).
①仪器A的名称是 _________ .
②装置B中发生反应的离子方程式是 _________ .
③有同学认为应在浓硫酸洗气瓶前增加吸收HCl的装置,你认为是否必要(填“是”或“否”) _________ .
(2)试剂X用于调节pH以除去杂质,X可选用下列试剂中的(填序号) _________ .
a.NaOHb.NH3•H2Oc.CuOd.Cu2(OH)2CO3e.CuSO4
(3)在溶液2转化为CuCl2•2H2O的操作过程中,发现溶液颜色由蓝色变为绿色.小组同学欲探究其原因.
已知:
在氯化铜溶液中有如下转化关系:
Cu(H2O)42+(aq)+4Cl﹣(aq)
CuCl42﹣(aq)+4H2O(l)
蓝色黄色
①上述反应的化学平衡常数表达式是K= _________ .若增大氯离子浓度,K值(填“增大”、“减小”或“不变”) _________ .
②取氯化铜晶体配制成蓝绿色溶液Y,进行如下实验,其中能够证明CuCl2溶液中有上述转化关系的是(填序号) _________ .
a.将Y稀释,发现溶液呈蓝色
b.在Y中加入CuCl2晶体,溶液变为绿色
c.在Y中加入NaCl固体,溶液变为绿色
d.取Y进行电解,溶液颜色最终消失.
15.(2014•东城区模拟)某校学生化学实验小组,为验证非金属元素氯的氧化性强于硫和氮,设计了一套实验装置:
(部分夹持装置已略去)
(1)写出A中反应的离子方程式 _________ .
(2)B中出现黄色浑浊现象,产生此现象的离子方程式 _________ .
(3)试从原子结构角度解释氯的氧化性大于硫的原因 _________ .
(4)D中干燥管中出现的现象及化学方程式 _________ .
(5)有同学认为D中的现象并不能说明氯的氧化性大于氮,需要在C之前加装洗气装置,请画出其装置图 _________ (并注明盛装试剂).
(6)还有什么方法能证明氧化性Cl2>S,用一种相关事实说明 _________ .
2014年4月新锐教育的高中化学组卷
参考答案与试题解析
一.填空题(共10小题)
1.(2013•房山区二模)资料显示:
在煤中加入适量石灰石粉可使煤(含S)燃烧时产生的SO2转化成固体CaSO4,从而减少SO2排放,该方法被称为钙基固硫.这一过程是通过以下两步反应实现的:
㈠CaCO3