基于实验化学之乙酸乙酯合成相关的试题命题研究.docx
《基于实验化学之乙酸乙酯合成相关的试题命题研究.docx》由会员分享,可在线阅读,更多相关《基于实验化学之乙酸乙酯合成相关的试题命题研究.docx(15页珍藏版)》请在冰点文库上搜索。
基于实验化学之乙酸乙酯合成相关的试题命题研究
2018年浙江高考化学选考试题第30题
30.【加试题】(10分)
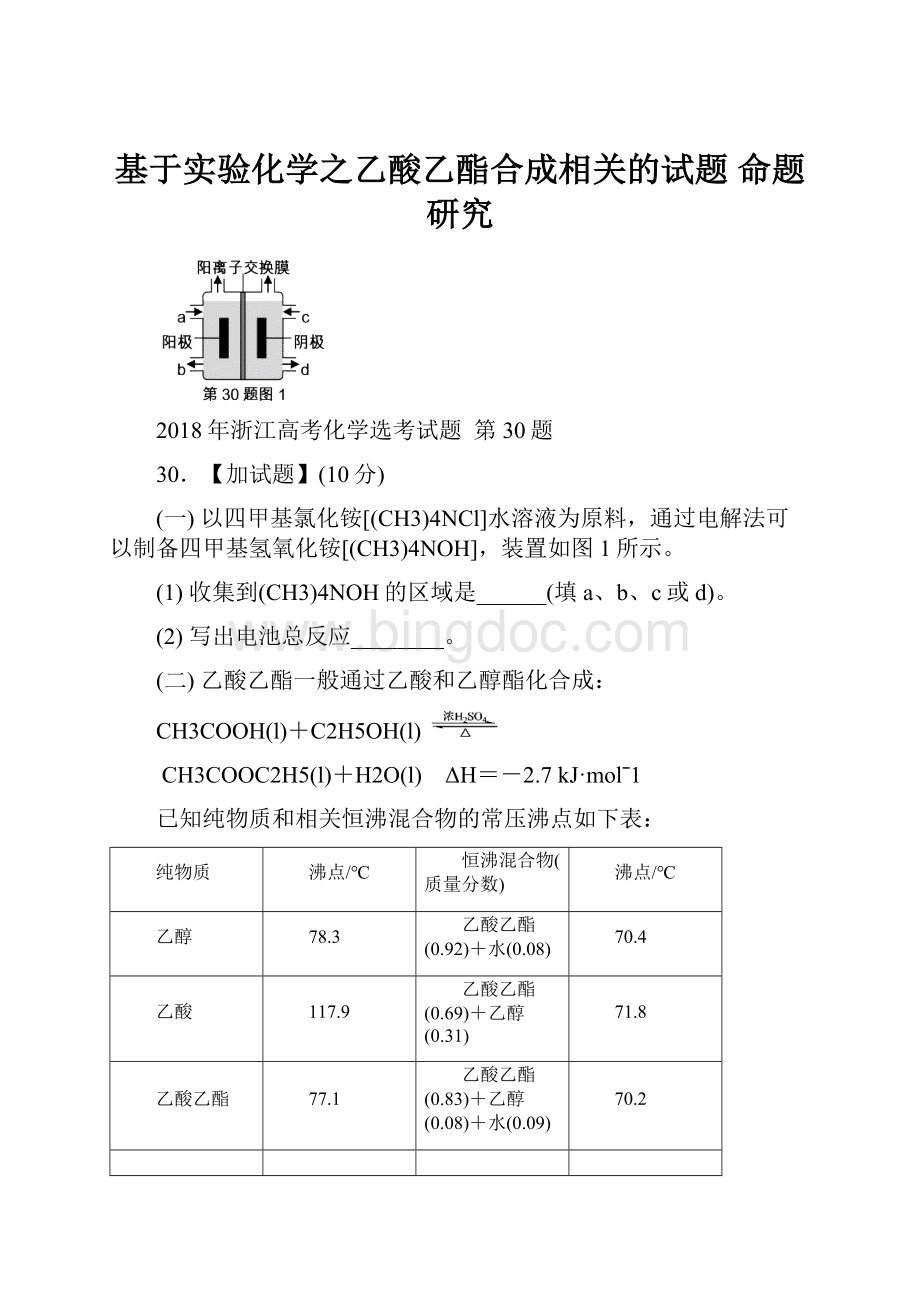
(一)以四甲基氯化铵[(CH3)4NCl]水溶液为原料,通过电解法可以制备四甲基氢氧化铵[(CH3)4NOH],装置如图1所示。
(1)收集到(CH3)4NOH的区域是______(填a、b、c或d)。
(2)写出电池总反应________。
(二)乙酸乙酯一般通过乙酸和乙醇酯化合成:
CH3COOH(l)+C2H5OH(l)
CH3COOC2H5(l)+H2O(l) ΔH=-2.7kJ·molˉ1
已知纯物质和相关恒沸混合物的常压沸点如下表:
纯物质
沸点/℃
恒沸混合物(质量分数)
沸点/℃
乙醇
78.3
乙酸乙酯(0.92)+水(0.08)
70.4
乙酸
117.9
乙酸乙酯(0.69)+乙醇(0.31)
71.8
乙酸乙酯
77.1
乙酸乙酯(0.83)+乙醇(0.08)+水(0.09)
70.2
请完成:
(1)关于该反应,下列说法不合理的是________。
A.反应体系中硫酸有催化作用
B.因为化学方程式前后物质的化学计量数之和相等,所以反应的ΔS等于零
C.因为反应的ΔH接近于零,所以温度变化对平衡转化率的影响大
D.因为反应前后都是液态物质,所以压强变化对化学平衡的影响可忽略不计
(2)一定温度下该反应的平衡常数K=4.0。
若按化学方程式中乙酸和乙醇的化学计量数比例投料,则乙酸乙酯的平衡产率y=________;若乙酸和乙醇的物质的量之比为n∶1,相应平衡体系中乙酸乙酯的物质的量分数为x,请在图2中绘制x随n变化的示意图(计算时不计副反应)。
(3)工业上多采用乙酸过量的方法,将合成塔中乙酸、乙醇和硫酸混合液加热至110℃左右发生酯化反应并回流,直到塔顶温度达到70~71℃,开始从塔顶出料。
控制乙酸过量的作用有________。
(4)近年,科学家研究了乙醇催化合成乙酸乙酯的新方法:
2C2H5OH(g)
CH3COOC2H5(g)+2H2(g)
在常压下反应,冷凝收集,测得常温下液态收集物中主要产物的质量分数如图3所示。
关于该方法,下列推测合理的是________。
A.反应温度不宜超过300℃
B.增大体系压强,有利于提高乙醇平衡转化率
C.在催化剂作用下,乙醛是反应历程中的中间产物
D.提高催化剂的活性和选择性,减少乙醚、乙烯等副产物是工艺的关键
30.(10分)
㈠
(1)
d(1分)
(2)
2(CH3)4NCl+2H2O
2(CH3)4NOH+H2↑+Cl2↑(1分)
㈡
(1)
BC(1分)
(2)
0.67或67%(1分)
(2分)
(3)
提高乙醇转化率;提高反应温度,从而加快反应速率;有利于后续产物的分离(2分)
(4)
ACD(2分)
2016年上海高考化学试题
六、(本题共12分)
乙酸乙酯广泛用于药物、染料、香料等工业,中学化学实验常用a装置来制备。
完成下列填空:
33.实验时,通常加入过量的乙醇,原因是______________。
加入数滴浓硫酸即能起催化作用,但实际用量多于此量,原因是_______________;浓硫酸用量又不能过多,原因是____________。
34.饱和Na2CO3溶液的作用是___________、_____________、_____________。
35.反应结束后,将试管中收集到的产品倒入分液漏斗中,_________、________,然后分液。
36.若用b装置制备乙酸乙酯,其缺点有__________、__________。
由b装置制得的乙酸乙酯粗产品经饱和碳酸钠溶液和饱和食盐水洗涤后,还可能含有的有机杂质是________,分离乙酸乙酯与该杂质的方法是_______________。
【答案】33.增大反应物浓度,使平衡向生成酯的方向移动,提高酯的产率。
(合理即给分)
浓H2SO4能吸收生成的水,使平衡向生成酯的方向移动,提高酯的产率。
浓H2SO4具有强氧化性和脱水性,会使有机物碳化,降低酯的产率。
34.中和乙酸、溶解乙醇、减少乙酸乙酯在水中的溶解
35.振荡、静置36.原料损失较大、易发生副反应乙醚;蒸馏
1(2015江苏卷)、下列设计的实验方案能达到实验目的的是()
A.制备Al(OH)3悬浊液:
向1mol·L-1AlCl3溶液中加过量的6mol·L-1NaOH溶液
B.提纯含有少量乙酸的乙酸乙酯:
向含有少量乙酸的乙酸乙酯中加入过量饱和碳酸钠溶液,振荡后静置分液,并除去有机相的水
C.检验溶液中是否含有Fe3+:
取少量待检验溶液,向其中加入少量新制氯水,再滴加KSCN溶液,观察实验现象
D.探究催化剂对H2O2分解速率的影响:
在相同条件下,向一支试管中加入2ml5%H2O2和1mlH2O,向另一支试管中加入2mL5%H2O2和1mLFeCl3溶液,观察并比较实验现象
【答案】BD
【解析】A、Al(OH)3是两性氢氧化物,可以和过量氢氧化钠反应生偏铝酸钠,故不能制备氢氧化铝悬浊液,错误;B、乙酸的酸性强于碳酸钠,饱和碳酸钠除去乙酸,还可以降低乙酸乙酯的溶解度使之析出,然后分液即可,故正确;C、氯水具有强氧化性,可能把Fe2+氧化成Fe3+,也会出现上述现象,故错误;D、两试管做对比实验,如果第二支试管冒出气泡多与第一支,说明FeCl3是催化剂,加快反应速率,故正确。
2(2014全国新课标Ⅰ)2.乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味,实验室制备乙酸异戊酯的反应、装置示意图和有关数据如下:
相对分子质量
沸点/℃
水中溶解性
异戊醇
88
0.8123
131
微溶
乙酸
60
1.0492
118
溶
乙酸异戊酯
130
0.8670
142
难溶
实验步骤:
在A中加入4.4g异戊醇、6.0g乙酸、数滴浓硫酸和2~3片碎瓷片,开始缓慢加热A,回流50min。
反应液冷至室温后倒入分液漏斗中,分别用少量水、饱和碳酸氢钠溶液和水洗涤;分出的产物加入少量无水MgSO4固体,静置片刻,过滤除去MgSO4固体,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯3.9g。
回答下列问题:
(1)仪器B的名称是________。
(2)在洗涤操作中,第一次水洗的主要目的是__________________________________,
第二次水洗的主要目的是__________________________________________________。
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后________(填标号)。
a.直接将乙酸异戊酯从分液漏斗的上口倒出
b.直接将乙酸异戊酯从分液漏斗的下口放出
c.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
d.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口倒出
(4)本实验中加入过量乙酸的目的是__________________________________________
________________________________________________________________________。
(5)实验中加入少量无水MgSO4的目的是_____________________________________。
(6)在蒸馏操作中,仪器选择及安装都正确的是______(填字母)。
(7)本实验的产率是________(填字母)。
a.30%b.40%
c.60%d.90%
(8)在进行蒸馏操作时,若从130℃开始收集馏分,会使实验的产率偏____(填“高”或“低”),其原因是______________________________________________________
________________________________________________________________________。
答案
(1)(球形)冷凝管
(2)洗掉大部分硫酸和醋酸 洗掉碳酸氢钠 (3)d (4)提高异戊醇的转化率
(5)干燥 (6)b (7)c (8)高 会收集少量未反应的异戊醇
解析 第1步,明确实验目的——确定实验原理。
实验室里用异戊醇(OH)与乙酸在浓H2SO4的催化作用下发生酯化反应生成乙酸异戊酯。
反应特点是可逆反应。
第2步,依据反应物的状态及反应条件,选择反应装置并控制合适的反应温度。
用装置A制备乙酸异戊酯,而提纯乙酸异戊酯需要用蒸馏的方法,蒸馏时要求温度计水银球位于蒸馏烧瓶的支管口处,球形冷凝管主要用于冷凝回流。
直形冷凝管用于蒸馏回收产品,故蒸馏操作应选择b。
第3步,根据有机反应中反应物的挥发性及有机副反应较多的特点,预测产品中可能的杂质,结合产品及可能杂质的性质特点,选择除杂试剂、装置以及步骤等。
产品乙酸异戊酯中含有的杂质为乙酸、异戊醇、硫酸,先用水洗去能溶于水的乙酸和硫酸,再用饱和NaHCO3溶液洗去残留的乙酸,然后再用水除去乙酸异戊酯中的NaHCO3,再用MgSO4进行吸水干燥,最后通过蒸馏除去异戊醇而得到纯度较高的产品。
第4步,利用方程式或关系式进行产品产率计算
实验过程中乙酸过量,从而使平衡正移,以提高异戊醇的转化率。
利用异戊醇(0.05mol)可以计算出乙酸异戊酯的理论产量,用实际产量与理论产量的比值可以得到本实验的产率。
5.在梨、香蕉等水果中存在着乙酸正丁酯。
实验室制备乙酸正丁酯的反应、装置示意图和有关数据如下:
CH3COOH+CH3CH2CH2CH2OH
CH3COOCH2CH2CH2CH3+H2O
水中溶解性
沸点
相对分子质量
乙酸
溶于水
1.0492
118
60
正丁醇
微溶于水
0.8098
117.7
74
乙酸正丁酯
微溶于水
0.8824
126.5
116
实验步骤:
Ⅰ.乙酸正丁酯的制备
在A中加入7.4g正丁醇、6.0g乙酸,再加入数滴浓硫酸,摇匀,放入1~2颗沸石。
按图安装带分水器的回流反应装置,并在分水器中预先加入水,使水面略低于分水器的支管口,通入冷凝水,缓慢加热A。
在反应过程中,通过分水器下部的旋塞分出生成的水,保持分水器中水层液面的高度不变,使油层尽量回到圆底烧瓶中。
反应达到终点后,停止加热,记录分出水的体积。
Ⅱ.产品的精制
把分水器中的酯层和A中反应液倒入分液漏斗中,分别用少量水、饱和碳酸钠溶液和水洗涤,分出的产物加入少量无水硫酸镁固体,静置后过滤,将产物常压蒸馏,收集124~126℃的馏分,得到5.8g产品。
请回答下列问题:
(1)冷水应从冷凝管的________(填“a”或“b”)口通入。
(2)产品的精制过程中,第一次水洗的目的是_________________________________________,第二次水洗的目的是______________________________,洗涤完成后将有机层从分液漏斗的________(填“上口”或“下口”)转移到锥形瓶中。
(3)本实验提高产品产率的方法是____________________________________________
________________________________________________________________________。
(4)判断反应终点的依据是__________________________________________________。
(5)该实验过程中,生成乙酸正丁酯的产率是__________________________________。
答案
(1)a
(2)除去大部分乙酸、正丁醇和硫酸 除去残留的钠盐 上口
(3)使用分水器分离酯化反应生成的水,使平衡正向移动
(4)分水器中的水层不再增加
(5)50%
解析
(1)冷凝管从下管口进水,上管口出水,使水充满冷凝管,提高冷凝效果。
(2)由于反应可逆,硫酸作催化剂,产品中有乙酸、正丁醇、硫酸残留,第一次水洗除去大部分乙酸、正丁醇、硫酸;第二次水洗除去未反应的Na2CO3和生成的钠盐;酯的密度小于水,在水的上层,从分液漏斗的上口倒出乙酸正丁酯。
(3)根据化学平衡移动原理,分离出生成物能促进平衡正向移动,提高产率。
(4)乙酸和正丁醇发生酯化反应生成乙酸正丁酯和水,分离器中的水层会不断上升,当分离器中的水面高度保持不变时,表明该酯化反应已经完成。
(5)理论上生成乙酸正丁酯11.6g,则产率为5.8g÷11.6g×100%=50%。
14分)苯甲酸甲酯是一种重要的工业原料,有机化学中通过酯化反应原理,可以进行苯甲酸甲酯的合成。
有关物质的物理性质、实验装置如下所示:
苯甲酸
甲醇
苯甲酸甲酯
熔点/℃
122.4
-97
-12.3
沸点/℃
249
64.3
199.6
密度/g.cm-3
1.2659
0.792
1.0888
水溶性
微溶
互溶
不溶
实验一:
制取苯甲酸甲酯
在大试管中加入15g苯甲酸和一定量的甲醇,边振荡边缓慢加入一定量浓硫酸,按图A连接仪器并实验。
(1)苯甲酸与甲醇反应的化学方程式为_______________ _________。
(2)大试管Ⅰ中除了装有15g苯甲酸和一定量的甲醇和一定量浓硫酸外还需要加入
。
(3)中学实验室中制取乙酸乙酯时为了提高酯的产率可以采取的措施有
__________________ ________ 。
实验二:
提纯苯甲酸甲酯
该实验要先利用图B装置把图A中制备的苯甲酸甲酯水洗提纯,再利用图C装置进行蒸馏提纯
(4)用图B装置进行水洗提纯时,B装置中固体Na2CO3作用是 。
(5)用图C装置进行蒸馏提纯时,当温度计显示______时,可用锥形瓶收集苯甲酸甲酯。
实验三:
探究浓硫酸在合成苯甲酸甲酯中的作用
(6)比较有、无浓硫酸存在条件下酯化反应进行的快慢,在其他实验条件相同时需要测量的实验数据是 。
【答案】;
(1)
(3分)
(2))碎瓷片
(3)使用浓硫酸吸水、把酯蒸出反应体系、提高醇的用量等
(能回答出两条措施即可给满分2分
(4)洗去苯甲酸甲酯中过量的酸 (2分) (5)199.6 (3分)(6)时间 (2分)
(1)苯甲酸与甲醇反应是酯化反应方程式为
(2)该反应是液体加热的反应所以在加热之前必须向溶液中加入碎瓷片,防止暴沸。
(3)酯化反应是一个可逆反应,要增大酯的浓度可以采取把酯蒸出,提高醇的用量的方法都可以使平衡向正向移动。
(4)制取的酯中经常含有乙醇和苯甲酸,乙醇易溶于水可除去
2007年江苏高考化学试题第18题
18.(12分)
酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、粘合剂及印刷、纺织等工业。
乙酸乙
酯的实验室和工业制法常采用如下反应:
CH3COOH+C2H5OH
CH3COOC2H5+H2O
请根据要求回答下列问题:
(1)欲提高乙酸的转化率,可采取的措施有、
等。
(2)若用右图所示装置来制备少量的乙酸乙酯,产率往往偏低,
其原因可能为、
等。
(3)此反应以浓硫酸为催化剂,可能会造成、等问题。
(4)目前对该反应的催化剂进行了新的探索,初步表明质子酸离子液体可用作此反应的催化剂,且能重复使用。
实验数据如下表所示(乙酸和乙醇以等物质的量混合)
同一反应时间
同一反应温度
反应温度/℃
转化率(%)
选择性(%)
反应时间/h
转化率(%)
选择性(%)
40
77.8
100
2
80.2
100
60
92.3
100
3
87.8
100
80
92.6
100
4
92.3
100
120
94.5
98.7
6
93.0
100
选择性100%表示反应生成的产物是乙酸乙酯和水
根据表中数据,下列(填字母)为该反应的最佳条件。
A.120℃,4hB.80℃,2hC.60℃,4hD.40℃,3h
当反应温度达到120℃时,反应选择性降低的原因可能为
参考答案:
(1)增大乙醇的浓度;移去生成物;
(2)原来来不及反应就被蒸出;温度过高,发生了副反应;冷凝效果不好,部分产物挥发出来。
(3)产生大量的酸性废液;部分原料炭化;催化剂重复使用困难;催化效果不理想。
(4)①C;②乙醇脱水生成了乙醚。