有机化学-电子效应和空间效应.ppt
《有机化学-电子效应和空间效应.ppt》由会员分享,可在线阅读,更多相关《有机化学-电子效应和空间效应.ppt(83页珍藏版)》请在冰点文库上搜索。
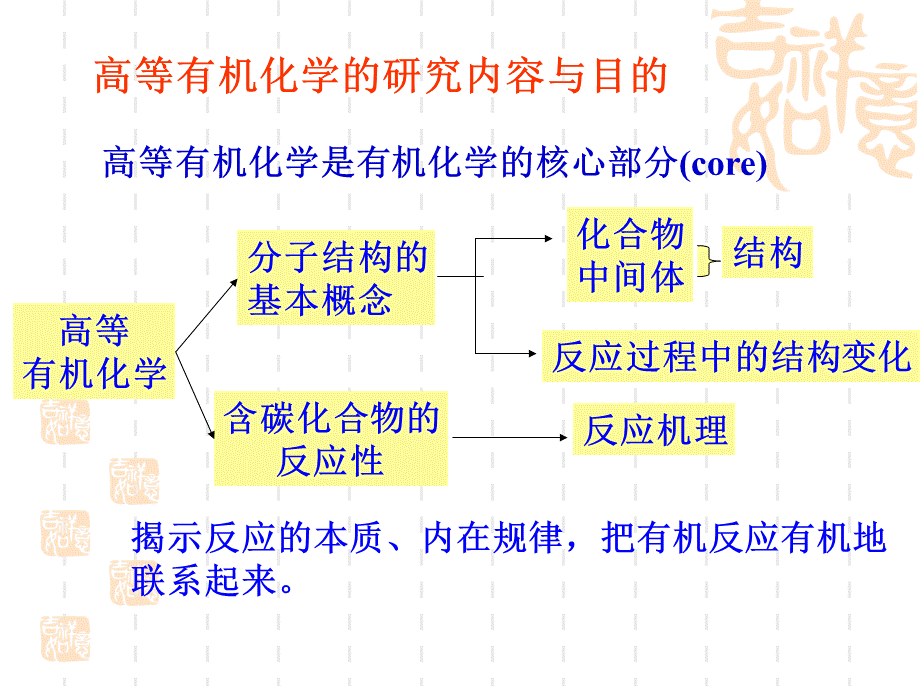
高等有机化学的研究内容与目的,高等有机化学是有机化学的核心部分(core),高等有机化学,分子结构的基本概念,含碳化合物的反应性,反应过程中的结构变化,反应机理,揭示反应的本质、内在规律,把有机反应有机地联系起来。
第二章有机化学的电子效应和空间效应,高等有机化学,孙晓霞,反应的本质:
旧键的断裂,新键的生成,共价键的极性取决于取代基的效应,CH3COOHClCH2COOHCl2CHCOOHCl3CCOOH,pKa4.762.861.290.65,取代基效应:
分子中的某个原子或原子团对整个分子,或分子中其它部分产生的影响,取代基效应,电子效应,场效应,空间效应,(位阻效应),空间传递,物理的相互作用,电子效应(Electroniceffect):
由于取代基的作用而导致的共有电子对沿共价键转移的结果(简称I效应)。
2.1诱导效应2.1.1静态诱导效应(Is)1.共价键的极性由不同原子形成的共价键,由于成键原子电负性不同,使成键电子云偏向电负性较大的原子,该原子带上部分负电荷,而电负性较小的原子带部分正电荷。
这种共价键具有极性。
2.1.1共价键的极性在成键原子间电子云并非完全对称分布,而是偏向电负性较高的原子一边,这样形成的共价键就具有了极性(polarity),称为极性共价键或极性键。
2.1诱导效应(Inductiveeffect),取代基的影响,分子链,传递,只涉及电子云密度改变,分布不均匀,取代基性质,方向,转移的结果,诱导效应,共价键极性主要决定于:
(1)成键原子的相对电负性大小。
电负性差别越大,键的极性越大。
(2)受相邻和不相邻原子或基团的影响。
C-C为非极性键,C-C为极性键,这种由于原子或基团电负性的影响沿着分子中的键传导,引起分子中电子云按一定方向转移或键的极性通过键链依次诱导传递的效应称为诱导效应(inductiveeffects)或I效应。
这种效应如果存在于未发生反应的分子中就称为静态诱导效应,用Is表示,其中S为static(静态)一词的缩写。
结构特征:
沿着单、双、叁键传递只涉及电子云密度分布的改变,不引起整个分子的电荷转移、价态的变化传递方式:
、键传递强度:
与距离相关。
距离越大,强度越弱。
诱导效应的相对强度:
取决于取代基距中心原子的距离,电负性(Electronegativeties),2.1.2诱导效应的传导,2.诱导效应由于成键原子电负性不同,引起电子云沿键链(键和键)按一定方向移动的效应或键的极性通过键链依次诱导传递的效应叫诱导效应。
sp3,sp2,通常以H的电负性作为衡量标准。
凡是比H电负性大的原子或基团叫吸电子基,其诱导效应叫吸电子诱导效应(-I),反之叫供电子基和供电子诱导效应(+I)。
+I,特点:
(1)诱导效应以静电诱导方式沿键链进行传递,只涉及电子云分布状况的改变和键极性的改变。
一般不引起整个电荷的转移和价态的变化;,
(2)诱导效应沿键链迅速减小,其影响一般在三个原子内起作用;(3)传递方向具有单一性。
K104-氯代丁酸14.0-氯代丁酸0.89-氯代丁酸0.26丁酸0.16氯原子距羧基越远,诱导效应作用越弱。
氯原子的诱导效应大致按公比1/3的等比级数急速减小。
经过三个原子之后,诱导效应已很微弱,超过五个原子便没有了,2.1.3诱导效应的加和性,诱导效应具有加和性,一个典型例子是-氯代乙酸的酸性。
氯原子取代越多,酸性越强。
pKaCH3COOH4.75ClCH2COOH2.86Cl2CHCOOH1.26Cl3CCOOH0.64,2.1.4静态诱导效应的相对强度电负性越大的基团或原子,其-I越大。
电负性越小,基团成原子的+I效应越大。
(1)同主族元素,从上到下,电负性降低,-I作用减小(+I增加);,FClBrI,电负性:
4.03.02.82.5,3.相同的原子:
不饱和度越大,-I效应越强,4.中心原子带有负电荷的比同类不带负电荷的基团供电诱导效应要强,2.1.4静态诱导效应的相对强度2.同周期,从左到右,电负性增加,-I增加(+I减低)。
2.1.4诱导效应强度的比较,
(1)根据酸碱的强度比较选取适当的酸或碱,以不同的原子或基团取代其中某一个氢原子,测定取代酸碱的离解常数,可以估算出这些原子或基团的诱导效应次序。
例如由各种取代乙酸的离解常数,可以得出下列基团诱导效应的强度次序。
+I效应:
N+(CH3)3NO2CNFClBrIOHOCH3C6H5CH=CH2HCH3CH2CH3C(CH3)3(-I效应的方向与此相反),2.1.5动态诱导效应(Id)静态诱导效应是分子本身的固有的性质,与键的极性(永久极性)有关。
在发生化学反应时,进攻试剂接近反应物分子时,因外界电场的影响使共价键电子云分布发生改变的效应叫动态诱导效应Id,又称可极化性,它是一种暂时性极化效应,但对反应方向影响极大,Id对反应起致活作用。
NO2的-Is使C-H极化具有一定的酸性,但却不能电离出质子,Id效应使其离解,2.1.6诱导效应对物质性质的影响1.对反应活性中间体稳定性的影响中心碳原子上连的烷基越多的碳正离子和碳自由基的稳定性越大,而碳负离子的稳定性正相反。
(烷基为供电基)2.对羧酸酸性的影响羧酸的酸性主要取决于O-H键离解的倾向以及共轭碱的稳定性,而诱导效应对两者均有影响。
凡是烃基上带吸电基时将增加羧酸的酸性,带供电基时减小其酸性。
2.1.7诱导效应对物质性质的影响,2.1.7.1对反应方向的影响
(1)丙烯与卤化氢加成,遵守马氏规则,而3,3,3-三氯丙烯加卤化氢则按反马氏规则的方向加成。
Cl3CCH=CH2+HClCl3CCH2CH2Cl
(2)在苯环的定位效应中,+N(CH3)3具有强烈的-I效应,所以是很强的间位定位基,在苯环亲电取代反应中主要得到间位产物,而且使亲电取代比苯难于进行。
2.1.7.2对反应机理的影响在一些反应中,由于诱导效应等因素可以改变其反应机理。
如溴代烷的水解反应,伯溴代烷如CH3Br主要按SN2历程进行,而叔溴代烷如(CH3)3CBr则主要遵从SN1历程进行。
2.1.7.3对反应速率的影响,例1羰基的亲核加成反应,羰基碳原子的电子云密度越低,就越容易和亲核试剂发生加成反应,在这种情况下,分子所需要的活化能就比较小,容易进入活化状态,因而反应速率较大。
故取代基的-I效应愈强,愈有利于亲核加成;取代基的+I效应愈强,对亲核加成愈不利。
如下列化合物发生亲核加成的活性顺序为:
Cl3CCHOCl2CHCHOClCH2CHOCH3CHO,2.1.7.4对化学平衡的影响,例1酸碱的强弱是由其解离平衡常数的大小来衡量的,在酸碱的分子中引入适当的取代基后,由于取代基诱导效应的影响,使酸碱离解平衡常数增大或减小。
如乙酸中的一个-氢原子被氯原子取代后,由于氯的-I效应,使羧基离解程度加大,而且使生成的氯乙酸负离子比乙酸负离子稳定,所以K2K1:
例2乙醛的水合反应是可逆的,形成的水化物很不稳定,只能存在于稀水溶液中。
而三氯乙醛的水合反应则比较容易,能生成稳定的水合物并能离析和长期存在。
主要是由于三氯甲基强烈的-I效应使羰基碳原子带部分正电荷,亲核反应容易进行,同时水合三氯乙醛因形成氢键也增加了稳定性。
习题1.下列羰基化合物分别与亚硫酸氢钠溶液加成,哪一个反应速度快?
哪一个最慢?
为什么?
2.2共轭效应,分子轨道理论认为共轭效应是轨道或电子离域于整个共轭体系乃至整个分子所产生的一种效应。
一电子离域与共轭效应现象1在CH2=CHCH=CH2中的键长不是简单的单键和双键的键长,存在着平均化的趋势。
CC单键键长0.154nmC=C双键键长0.134nm1,3-丁二烯CC单键键长0.147nmC=C双键键长0.137nm体系能量降低,化合物趋于稳定。
现象2氯乙烯与氯乙烷比较,从诱导效应考虑,由于键的电子云流动性较大,氯乙烯(=1.44D)的偶极矩应该加大,但实际上却比氯乙烷(=2.05D)的偶极矩小。
氯乙烯也同样存在着单双键平均化的趋势。
一般化合物C=C0.134nmC-Cl0.177nm氯乙烯0.138nm0.172nm,这些现象说明,在单双键交替排列的体系中,或具有未共用电子对的原子与双键相连的体系中,轨道与轨道或p轨道与轨道之间存在着相互的作用和影响。
电子云不再定域于成键原子之间,而是离域于整个分子形成了整体的分子轨道。
每个成键电子不仅受到成键原子的原子核的作用,而且也受到分子中其他原子核的作用,因而分子整体能量降低,体系趋于稳定。
这种现象称为电子的离域(delocalization),这种键称为离域键,由此而产生的额外的稳定能称为离域能(也叫共轭能或共振能)。
包含着这样一些离域键的体系通称为共轭体系,在共轭体系中原子之间的相互影响的电子效应叫共轭效应(conjugativeeffects)。
按照共轭效应的起源,可以将共轭效应分为静态共轭效应与动态共轭效应。
2.共轭效应与诱导效应的区别,
(1)共轭效应起因于电子的离域,而不仅是极性或极化的效应。
(2)共轭效应只存在于共轭体系中,不象诱导效应那样存在于一切键中。
(3)诱导效应是由于键的极性或极化性沿键传导,而共轭效应则是通过电子的转移沿共轭链传递,是靠电子离域传递;共轭效应的传导可以一直沿着共轭键传递而不会明显削弱,不象诱导效应削弱得那么快,取代基相对距离的影响不明显,而且共轭链愈长,通常电子离域愈充分,体系能量愈低愈稳定,键长平均化的趋势也愈大。
2.2共轭效应,2.2.1共轭体系包含三个或三个原子以上的键叫共轭键,此体系叫共轭体系。
-共轭,-共轭体系的结构特征是单双键交替:
参与共轭的双键不限于两个,亦可以是多个:
形成-共轭体系的重键不限于双键,叁键亦可;组成共轭体系的原子亦不限于碳原子,氧、氮原子均可。
例如,下列分子中都存在-共轭体系:
用弯箭头表示由共轭效应引起的电子流动方向;共轭碳链产生极性交替现象,并伴随着键长平均化;降低了分子的能量,提高了体系的稳定性共轭效应不随碳链增长而减弱。
小结,电子离域用弯箭头表示,从双键到直接相连的原子或单键上,2.2共轭效应,p-共轭:
由键的p轨道和sp2碳原子的空p轨道相互平行且交盖.,碳正离子的稳定性:
超共轭,丙烯分子中的超共轭,轨道和碳氢轨道的交盖,使原来基本上定域于两个原子周围的电子云和电子云发生离域而扩展到更多原子的周围,增加了键的电子云密度,降低了分子的能量,增加了分子的稳定性,轨道与轨道参与的电子离域作用称为超共轭效应,亦称,-共轭效应。
超共轭效应比,-共轭效应弱得多。
超共轭效应所致。
通常用下列方法表示离域(即超共轭作用):
参与超共轭的C-H键越多,越有利于碳正原子上正电荷的分散碳正离子越稳定:
碳正离子的结构,-p超共轭效应,与碳正离子相似,许多自由基中也存在着超共轭。
自由基的稳定顺序同样是:
2.2.2共轭效应(C效应)共轭体系中的电子云是离域的而不是定域的,使得所涉及到化学键平均化,这种在共轭体系中原子之间的相互影响的的电子效应叫共轭效应。
特点:
共轭效应只存在共轭体系中,而且只在共轭体系传递,无论共轭体系有多大,C效应都能传递到共轭体系末端,而且不因传递距离增加而减弱,在共轭体系中的原子依次出现电荷呈正负交替分布。
共轭效应的起因是电子的离域,而且诱导效应起因于键的极性或极化。
共轭效应:
取代基效应,共轭体系,传递,特点:
分子中任何一个原子周围电子云密度变化,马上会引起其它部分的电子云密度的改变,共轭效应不受传递距离的影响,结构特征:
单、重键交替,共轭体系中所有原子共平面,苯酚分子中氧原子上的孤对电子与苯环上的电子形成p-共轭。
结果:
使羟基的邻、对位的碳原子带有部分的负电荷。
传递方式:
键,相对强度:
电子转移用弧形箭头表示,Y为吸电子基团时吸电子共轭效应(-C),X为供电子基团时供电子共轭效应(+C).,2.2.3共轭效应的相对强度1同一主族元素,随着原子序数增大,原子半径增大,与碳的p轨道重叠程度逐渐减小,+C降低,2同周期元素
(1)-共轭体系中,随原子序数增大,电负性增大,-C增大。
(2)p共轭中,电负性增大,给电子能力下降,C下降。
3取代基上带有正电荷时,-C增加;带负电荷时,C增加。
+C效应在同族中随中心原子的原子序数增大而降低。
2.2.4共轭效应对化学性质的影响1.酸碱性影响羧酸的酸性大小,而醇羟基中无共轭效应,其酸性极弱通常降低胺的碱性,羧酸的酸性是因为羧酸分子中具有p-共轭,增大了O-H键的极性,促使氢容易离解,且形成的羧基负离子共轭效应增强,更稳定。
醇一般为中性,苯酚由于p-共轭,有一定的酸性。
三硝基苯酚中,由于三个强吸电子硝基的共轭和诱导作用,使其显强酸性,已接近无机酸的强度。
2.2.4共轭效应对化学性质的影响1.酸碱性,烯醇式的1,3-二酮具有微弱的酸性,也是由于p-共轭作用。
烯醇烯醇负离子由于p-共轭效应,芳香胺如苯胺的碱性比脂肪族胺弱,而酰胺则几乎呈中性。
2.加成方向,甲基的+C和+I效应,烯键末端具有亲核性,反应为亲电加成反应。
-C效应使烯酮具有亲电性,反应为亲核加成反应。
23超共轭效应(C)凡是CH键与键的共轭叫超共轭,其产生的电子效应叫超共轭效应。
但这种电子效应不如共轭效应,这是一种弱的电子效应。
结果使C-C变短,CH键的数目越多,超共轭效应越强,相应的烯烃就越稳定。
I和C使碳正离子和碳自由基稳定,sp2,起主导作用,四.场效应(Fieldeffect),当分子中原子或原子团间相互作用,通过空间传递的电子效应场效应。
邻氯代苯丙炔酸:
pKa:
大,小,场效应是依赖分子的几何构型的。
场效应:
某些取代基的静电作用通过空间对反应中心发生影响的诱导效应。
酸性:
原因:
邻卤代苯丙炔酸中,卤素原子的吸电子诱导效应使得酸性增强,而CX键偶极的场效应又使酸性减弱。
对位或间位的卤素原子和羧基的质子相距较远,不存在场效应,所以邻卤代苯丙炔酸的酸性较相应的间位和对位酸的酸性稍弱。
场效应与诱导效应,诱导效应本质上是一种静电作用。
如果静电作用通过空间传递的效应称为场效应。
场效应和诱导效应通常难以区分的。
因为它们往往同时存在,而且作用方向一致。
所以也把诱导效应和场效应总称为极性效应。
如果仅从诱导效应考虑,顺式和反式是没有区别的。
但在第二次电离时,却由于-COO-负离子供电的场效应,使顺式的酸性低于反式。
如果单从诱导效应考虑,两者应没有区别。
-I,场效应有利于第一质子的离去,+I,场效应不有利于第二质子的离去,+I,-I,但在第二次电离时,却由于-COO-负离子供电的场效应,使顺式的酸性低于反式。
如果单从诱导效应考虑,两者应没有区别。
对于二元羧酸来说,分子中有两个羧基,它们的氢原子可分两步离解:
Ka1Ka2,羧基是电负性较大的吸电子基团,在吸电子作用影响下另一个羧基容易离解,两个羧基距离的增大而相应地减弱,二元羧酸的一个羧基发生电离后,由于场效应(负电场)的影响,第二步电离所生成的产物是带两个负电荷的离子,存在两个负电荷之间的相互排斥作用,不稳定,难于生成,五空间效应,分子中原子之间的相互影响并不完全归结为电子效应,有些则是与原子(或基团)的大小和形状有关,这种通过空间因素所体现的原子之间的相互影响通常称为空间效应,或叫立体效应(stericeffects)。
例1()()pKa=7.16pKa=8.24,五.空间效应(Stericeffect),分子内或分子间不同取代基相互接近时,由于取代基的体积大小、形状不同,相互接触而引起的物理的相互作用空间效应(位阻效应)。
空间效应的作用:
1.化合物(构象)的稳定性,SN2反应理想的过渡态,具有五配位中心碳原子上的三角双锥几何形状,空间因素对反应有显著影响:
显然,反应中心碳原子上烷基数目越多,烷基体积越大,过渡态的中心碳原子周围的拥挤程度就越严重,必然会显著地降低反应速率。
对于SN2历程的反应,或碳上有分支、空间位阻愈大,都使反应速率减慢。
亲核取代反应,两组实验数据:
在C2H5OH中,C2H5ONa与不同RBr于55发生SN2反应的相对速率:
可见,C上取代基越大,空间障碍越大,SN2速率越小。
(1)烷基结构对SN2反应的影响,SN2反应活性:
CH3X1RX2RX3RX,SN2反应中的空间效应,立体效应碳原子上的甲基能阻碍亲核试剂的接近,提高了反应的活化能而使反应速度降低.电子效应碳原子上的氢被烷基取代后,碳原子上的电子云密度将增加,也不利于亲核试剂对反应中心的接近.,一般认为:
立体效应的影响大于电子效应.,对于SN1反应来说,在速度控制步骤的解离过程中,中心碳原子由原来的sp3杂化的四面体变为sp2杂化的平面或近于平面的碳正离子,一定程度解除了拥挤状态(张力的解除)。
中心碳原子上取代基越多,取代基体积越大,过渡态中拥挤状态减轻的相对程度就更大,速率的增加也就更显著。
按SN1历程进行的反应,碳原子的分支使反应速率增加。
主要原因是碳正离子的稳定性,通常叔碳正离子仲碳正离子伯碳正离子。
位的分支对于SN1反应速率的影响较小,通常是分支加大,SN1反应速率仅略有增加。
(2)烷基结构对SN1反应的影响,决定SN1反应速度的是C稳定性。
越是稳定的C,越容易生成。
C稳定性:
321CH3(p超共轭)SN1反应活性:
3RX2RX1RXCH3X,例如,在甲酸水溶液中,RBr的水解相对速度为:
(CH3)3CBr(CH3)2CHBrCH3CH2BrCH3Br,问题:
(CH3)3CCH2Br(A)或(CH3)3CBr(B)在水甲酸溶液中何者水解速度快?
极性较强的溶剂(考虑C+稳定性),答案:
反应速度:
BA,CH3Br、(CH3)2CHBr、(CH3)3CBr这个系列中,水解历程是一个由SN2转变为SN1的过程。
3RX主要SN1反应;1RX主要SN2反应;2RX同时SN1和SN2,但SN1和SN2速度都很慢。
3.对反应活性的影响,伯卤代烷的乙醇解的相对速度是与中心碳原子连接的烷基大小相关的:
环体系对亲核取代反应速率的影响。
无论SN1还是SN2反应,速度控制步骤的过渡态都要求作用物由四面体形变为平面的或近于平面的sp2杂化的构型,这就要求小环分子发生较大的变形。
在桥环化合物中,当离去基团位于桥头碳原子上时,由于该碳原子既难于变为平面或近于平面的构型,又由于笼状结构的空间位阻关系排除了亲核试剂从离去基团背面进攻的可能性,因而发生SN1反应与SN2反应都很困难。
消除反应,烷基结构的影响,无论E1或E2,卤代烷的消除反应活性都是:
321RX原因:
对于E1,考虑C+稳定性:
321,对于E2,考虑过渡态稳定性:
无论E1或E2,卤代烷的消除反应活性都是:
321RX,空间效应的影响:
1)离去基团的大小,当离去基团的体积大时,碱不易进攻1位的氢,而易进攻2位的氢。
2)底物结构的影响,E2反应的立体化学,E2按反式消除,顺式消除,处于反式的氢在e键上,与OTs不在一个平面上,反应按E1机理进行。
顺式消除情况很少:
氢化原菠烷基溴,由于环的刚性,BrCCH不能同处一个平面,但BrCCD共平面。
是顺叠构象,所以进行顺式消除。
Ha与芳环同碳相连,其活泼性比Hb高,故发生顺式消除。
2.化合物的酸碱性,pKa1pKa2,当t-Butyl在邻位时,把羧基挤出了与苯环所在平面,羧基的C效应消失。
吸电子基团使酸性增强。
供电子基团使酸性减弱。
总规律:
吸电子,酸性增强;供电子酸性减弱。
羧酸酸性的影响,取代基具有吸电子共轭效应时,酸性强弱顺序为:
邻对间取代基具有给电子共轭效应时,酸性强弱顺序为:
邻间对,具体分析:
邻位(诱导、共轭、场、氢键效应、空间效应均要考虑。
)对位(诱导很小、共轭为主。
)间位(诱导为主、共轭很小。
),取代羧酸的酸性与在烃基同一位置上引入-I基团的数目有关,数目越多,酸性越强。
取代羧酸的酸性与-I基团离羧基的距离有关,距离越远,影响越小,每隔一个共价键,其诱导效应以几何级数降低。
邻位间位对位,诱导吸电子作用中、共轭给电子作用小。
诱导吸电子作用小、共轭给电子作用大。
pka2.98pka4.08pka4.57,苯甲酸的pka4.20,诱导吸电子作用大、共轭给电子作用大、氢键效应吸电子作用大。
当胺同质子酸作用时,其碱性强度顺序为:
R3NR2NHRNH2NH3,对碱性的影响,R2NHRNH2R3NNH3,NH2IR+I给电子,叔胺:
三个烷基的空间效应,不利于氢离子的结合,溶剂化效应弱,Y,NH2,Y,NH2,Y为给电子基团,-NH2的碱性增强,Y为吸电子基团,-NH2的碱性减弱,ArNH2:
结论:
NH2I+CAr+IC吸电子,胺基的碱性,氨基未共用电子对与苯环产生p-共轭,电子云密度下降,碱性降低,空间位阻对反应的影响,作用1:
可以利用磺酸暂时占据环上的某些位置,使这个位置不再被其它基取代.作用2:
或利用磺酸基的存在,影响其水溶性等,待其他反应完毕后,再经水解将磺酸基脱去.,