人教版九年级化学下册第十单元酸和碱知识点.docx
《人教版九年级化学下册第十单元酸和碱知识点.docx》由会员分享,可在线阅读,更多相关《人教版九年级化学下册第十单元酸和碱知识点.docx(18页珍藏版)》请在冰点文库上搜索。
人教版九年级化学下册第十单元酸和碱知识点
第十单元酸和碱课题1常见的酸和碱
知识点1:
酸碱指示剂
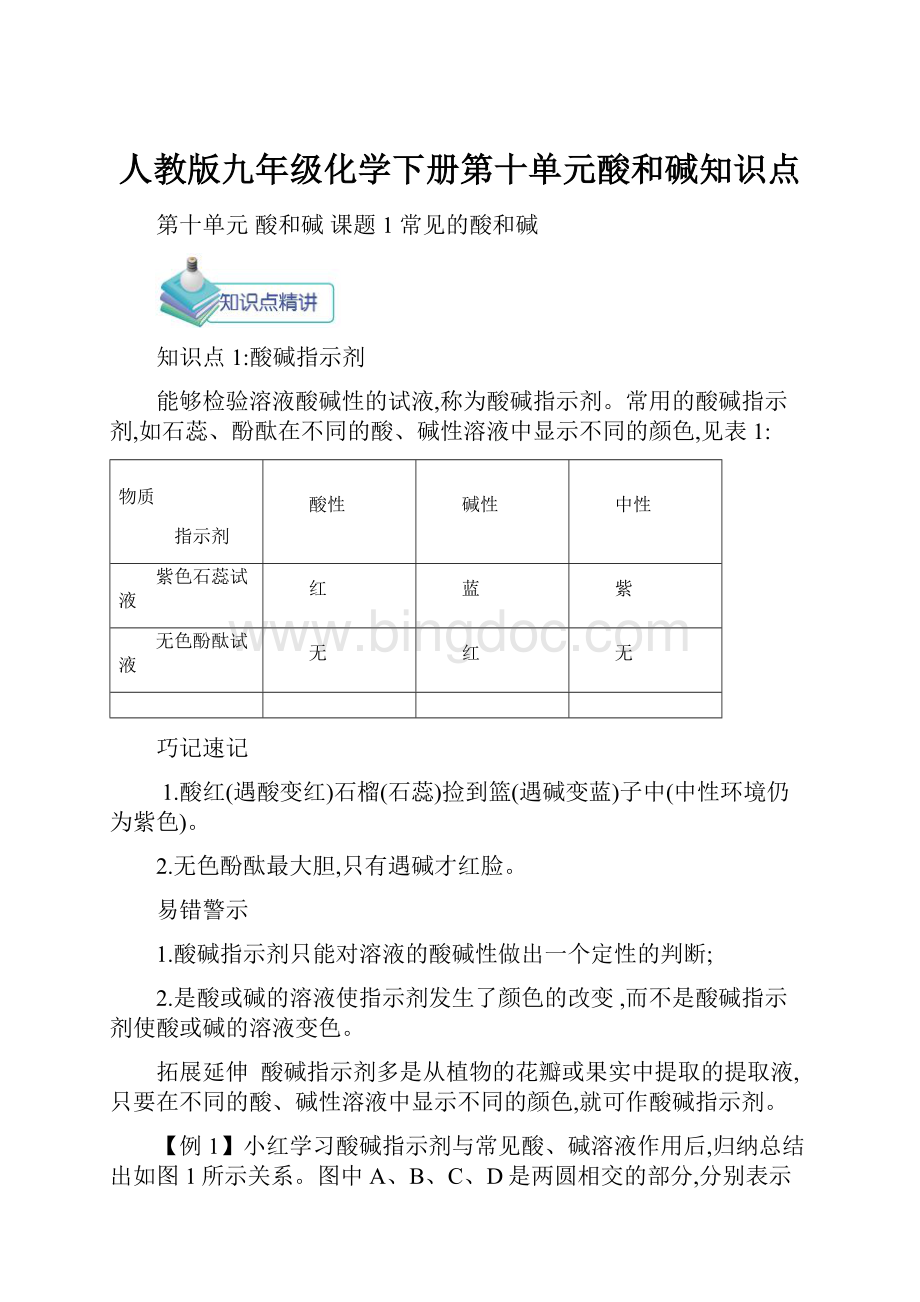
能够检验溶液酸碱性的试液,称为酸碱指示剂。
常用的酸碱指示剂,如石蕊、酚酞在不同的酸、碱性溶液中显示不同的颜色,见表1:
物质
指示剂
酸性
碱性
中性
紫色石蕊试液
红
蓝
紫
无色酚酞试液
无
红
无
巧记速记
1.酸红(遇酸变红)石榴(石蕊)捡到篮(遇碱变蓝)子中(中性环境仍为紫色)。
2.无色酚酞最大胆,只有遇碱才红脸。
易错警示
1.酸碱指示剂只能对溶液的酸碱性做出一个定性的判断;
2.是酸或碱的溶液使指示剂发生了颜色的改变,而不是酸碱指示剂使酸或碱的溶液变色。
拓展延伸 酸碱指示剂多是从植物的花瓣或果实中提取的提取液,只要在不同的酸、碱性溶液中显示不同的颜色,就可作酸碱指示剂。
【例1】小红学习酸碱指示剂与常见酸、碱溶液作用后,归纳总结出如图1所示关系。
图中A、B、C、D是两圆相交的部分,分别表示指示剂与酸、碱溶液作用时所显示出的颜色,其中颜色不正确的是( )
图1
A.紫色 B.蓝色 C.红色 D.无色
知识点2:
浓盐酸和浓硫酸的物理性质及特性
浓盐酸和浓硫酸的物理性质及特性见表2:
颜 色
状 态
气 味
特 性
浓盐酸
无色
液态
刺激性气味
易挥发
浓硫酸
无色
黏稠、油状、液态
无味
吸水性、脱水性、腐蚀性
易错警示 浓硫酸的吸水性和脱水性比较见表3。
性质表现
水的含义
吸水性
物理性质
某物质中所含的水分
脱水性
化学性质
某物质中没有水,而是将该物质中的氢、氧两种元素按水的组成比脱去
【例2】若将浓盐酸和浓硫酸敞口放置在空气中,一段时间后,可以肯定的是( )
A.溶质质量都减少 B.溶剂质量都增大
C.溶液质量都增大 D.溶质的质量分数都减小
知识点3:
浓硫酸的稀释
实验室中常备有浓硫酸,在具体的化学实验中常用到稀硫酸,需将浓硫酸进行稀释(见表4)。
操 作
现 象
解 释
图(a)操作错误。
为说明错误操作的危害,在图(b)特定的装置内把少量水滴进浓硫酸中
液滴
四溅
水的密度较小,浮在浓硫酸上面,溶解时放出的热会使水立刻沸腾,使硫酸液滴向四周飞溅,这是非常危险的
图(c)操作正确。
将浓硫酸沿器壁慢慢注入水中,并不断搅拌
烧杯壁发热,没有液滴四溅现象
将密度大的浓硫酸缓慢注入水中,及时搅拌,产生的热得以迅速扩散,操作安全
巧记速记 稀释浓H2SO4,应防酸飞溅;硫酸注入水,同时再搅拌
易错警示 稀释浓硫酸时,一定要把浓硫酸沿器壁慢慢注入水里,并不断搅拌,切不可将水倒进浓硫酸里。
如果将水倒进浓硫酸里,由于水的密度小,浮在浓硫酸的上面,硫酸溶解时放出的热量不易散失,使水暴沸,带着酸四处飞溅。
拓展延伸 如果不慎将浓硫酸沾到皮肤上或衣服上,应立即用大量水冲洗,然后再涂上3%~5%的碳酸氢钠溶液。
表4图(b)中,双孔塞上的短玻璃导管的作用是平衡装置内外的压强,防止装置内的气压突增而发生事故。
【例3】 图2所示是稀释浓硫酸实验的示意图。
图2
(1)写出图中a、b两种仪器的名称:
a ;b 。
(2)b容器所盛的试剂是 (填“水”或“浓硫酸”)。
(3)稀释时,若两种试剂添加顺序颠倒,将会发生 的现象。
(4)[联系与拓展]据媒体报道,2009年7月,从宁乡到北京打工的一名工人,在极度口渴的情况下误喝硫酸,造成食道严重灼伤伴穿孔,这是因为硫酸具有 。
这一事件警示我们:
存放或使用药物时应注意 。
知识点4:
盐酸、硫酸的化学性质
盐酸、硫酸具有相似的化学性质,如表5所示:
实验内容
现 象
原理(或化学方程式)
酸碱指示剂
紫色石蕊溶液遇酸变红,无色酚酞溶液遇酸不变色
金属
镁
剧烈反应,产生大量的气泡
Mg+2HCl
MgCl2+H2↑
Mg+H2SO4
MgSO4+H2↑
锌
反应较快,有大量气泡产生
Zn+2HCl
ZnCl2+H2↑
Zn+H2SO4
ZnSO4+H2↑
铁
溶液由无色变成浅绿色,有气泡产生
Fe+2HCl
FeCl2+H2↑
Fe+H2SO4
FeSO4+H2↑
金属
氧化
物
铁锈
(Fe2O3)
铁锈溶解,溶液由无色变成棕黄色
Fe2O3+6HCl
2FeCl3+3H2O
Fe2O3+3H2SO4
Fe2(SO4)3+3H2O
氧化铜
固体溶解,溶液由无色变成蓝色
CuO+2HCl
CuCl2+H2O
CuO+H2SO4
CuSO4+H2O
某些盐
碳酸钙
(和盐酸)
固体溶解,有大量气体产生,该气体能使澄清石灰水变浑浊
CaCO3+2HCl
CaCl2+CO2↑+H2O
碳酸钠
Na2CO3+2HCl
2NaCl+H2O+CO2↑
Na2CO3+H2SO4
Na2SO4+CO2↑+H2O
巧记妙记 酸与各类物质反应可按图3所示巧记,其中手掌代表酸,五个手指代表与酸反应的五类物质。
图3
易错警示 1.盐酸、硫酸溶液与铁反应后,生成的FeCl2、FeSO4的溶液为浅绿色,其中铁元素为+2价;而与铁锈(Fe2O3)反应生成的是FeCl3、Fe2(SO4)3的溶液,为棕黄色溶液,其中铁元素为+3价。
2.在与金属反应时,稀硫酸与金属反应可以生成H2;浓硫酸有强氧化性,与金属反应不能生成H2。
【例4】 白蚁能分泌出蚁酸。
蚁酸的化学性质与盐酸相似,能腐蚀很多物质。
下列最不容易被蚁酸腐蚀的是( )
A.镀锌水管 B.铜制塑像 C.大理石栏杆 D.铝合金门窗
知识点5:
盐酸和硫酸的用途
盐酸和硫酸的用途见表6。
用 途
硫酸
重要化工原料,用于生产化肥、农药、火药、染料以及冶炼金属、精炼石油和金属除锈等。
浓硫酸有吸水性,在实验室中常用它作干燥剂
盐酸
重要化工产品,用于金属表面除锈、制药(如盐酸麻黄素、氯化锌)等;人体胃液中含有盐酸,可帮助消化
易错警示 1.浓硫酸作干燥剂时,需干燥的气体一定从长管通入,从短管导出,即归纳为:
长进短出。
如图4:
图4
2.选择干燥剂的原则是干燥剂只能吸收水分,不能与被干燥的物质发生反应。
浓硫酸常用来干燥O2、H2、CO2、CH4、CO等,不能用来干燥NH3。
【例5】下列气体中不宜用浓硫酸干燥的是( )
A.CO2 B.NH3 C.O2 D.HCl
知识点6:
氢氧化钠和氢氧化钙的物理性质
氢氧化钠和氢氧化钙的物理性质及特性见表7。
氢氧化钠(NaOH)
氢氧化钙[Ca(OH)2]
俗名
苛性钠、火碱、烧碱
熟石灰、消石灰
颜色、状态
白色块状固体
白色粉末状固体
溶解性
易溶于水,且放出大量的热
微溶于水
特性
易潮解;强腐蚀性
较强腐蚀性
易错警示 固体氢氧化钠曝露在空气中,易吸收空气中的水分,使固体表面潮湿并逐渐溶解,这种现象叫潮解,潮解是一个物理变化过程,没有新的物质生成。
拓展延伸 氢氧化钙可由生石灰与水反应制得:
CaO+H2O
Ca(OH)2,反应放出大量的热。
生石灰常用作食品干燥剂。
【例6】如图5所示,打开止水夹,将液体A滴入试管①中与固体B接触。
若试管②中的导管口没有气泡产生,则液体A和固体B的组合可能是下列中的( )
A.稀盐酸和铁 B.水和生石灰 C.水和氢氧化钠 D.水和氯化钠
图5
知识点7:
氢氧化钠、氢氧化钙的化学性质
氢氧化钠、氢氧化钙的化学性质见表8。
氢氧化钠(NaOH)
氢氧化钙[Ca(OH)2]
与指示剂作用
能使紫色石蕊溶液变蓝色,使无色酚酞溶液变红色
与某些非金属氧化物反应
CO2
CO2+2NaOH
Na2CO3+H2O
CO2+Ca(OH)2
CaCO3↓+H2O
SO2
SO2+2NaOH
Na2SO3+H2O
SO2+Ca(OH)2
CaSO3↓+H2O
SO3
SO3+2NaOH
Na2SO4+H2O
SO3+Ca(OH)2
CaSO4↓+H2O
与某些盐反应
FeCl3+3NaOH
Fe(OH)3↓+3NaCl
(常用于制不溶性碱)
CuSO4+2NaOH
Cu(OH)2↓+Na2SO4
Ca(OH)2+Na2CO3
CaCO3↓+2NaOH
(工业制碱中用此法能制得纯度较高的NaOH)
巧记速记 碱的化学性质可按图6巧记,其中手掌代表碱,四个手指代表与碱反应的四类物质(注意与酸对应,酸能与金属反应,但碱不能与非金属反应,故食指空缺)。
图6
易错警示 1.能使酸碱指示剂变色的碱必须是可溶性的碱,有些难溶性的碱如Cu(OH)2(蓝色固体)、Fe(OH)3(红褐色固体)等不能使酸碱指示剂变色。
2.氢氧化钠密封保存的原因有两点:
一是易潮解,二是易吸收CO2发生变质。
拓展延伸 由于NaOH易溶于水,所以常用NaOH溶液吸收CO2;由于CO2与Ca(OH)2溶液反应生成白色沉淀,所以实验室常用Ca(OH)2溶液检验CO2。
【例7】小黎同学为了进一步加深对“碱的化学性质”的理解,特邀你协助完成下列活动与探究:
(1)如图7所示,在白色点滴板上进行实验,请将实验现象填入表9:
氢氧化钠溶液
氢氧化钙溶液
加紫色石蕊溶液
(2)回忆检验二氧化碳气体的反应,写出该反应的化学方程式 。
(3)三氧化硫(SO3)与氢氧化钠反应与上面的反应类似,写出这一反应的化学方程式 。
(4)根据上面的实验和讨论,试归纳出氢氧化钠、氢氧化钙有哪些相似的化学性质。
(任写两点)
① ;
② 。
知识点8:
氢氧化钠、氢氧化钙的用途
氢氧化钠、氢氧化钙的用途见表10。
氢氧化钠
氢氧化钙
用途
重要化工原料,应用于肥皂、石油、造纸、纺织、印染等工业;生活中可用来除油污;在实验室用作干燥剂
重要的建筑材料,也是一种工业原料。
如制漂白粉,在农业上用于改良酸性土壤
易错警示 由于氢氧化钠能与CO2、SO2、HCl气体发生反应,因此不能用氢氧化钠固体干燥CO2、SO2、HCl气体,但H2、O2、CO等气体可以用氢氧化钠固体干燥。
【例8】 生石灰是白色的块状物,应用非常广泛。
(1)生石灰的成分为 (填化学式)。
在食品包装中,常用生石灰作干燥剂,其干燥原理是 (用化学方程式表示);在使用时,是用纸袋装着生石灰放入食品包装盒中,如果用塑料袋装生石灰就起不到干燥的作用,原因是 。
(2)在农村,生石灰也常用于畜禽栏舍的消毒。
畜禽出栏后,将生石灰用水调成20%的石灰乳,涂刷墙面和地面。
某农户误将生石灰直接撒在猪圈中消毒,一段时间后发现猪的蹄部干燥开裂,有的甚至出现灼伤、溃烂,原因是 。
(3)上述用于消毒的浆状物要现配现用,放置过久,就没有消毒作用了,其原因是 (用化学方程式表示)。
考点:
碱的通性
【例】 已知氢氧化锂(LiOH)可溶于水,其化学性质与氢氧化钠相似。
下列对氢氧化锂的化学性质的说法中错误的是( )
A. 能与二氧化碳反应 B.能使无色酚酞溶液变红
C.能与稀硫酸反应 D.能使紫色石蕊溶液变红
第十单元酸和碱课题2酸和碱的中和反应
知识点1:
酸和碱的反应实验
实验设计 1.原理:
氢氧化钠溶液与盐酸能发生反应,但没有明显的反应现象,需借助酚酞指示剂,通过观察颜色的变化,判断二者是否恰好反应。
2.仪器:
烧杯、玻璃棒、滴管。
3.药品:
NaOH溶液、稀盐酸、酚酞溶液。
4.步骤:
如图1所示,在烧杯中加入10mLNaOH溶液,滴入几滴酚酞溶液,此时烧杯中的溶液显红色,再用滴管慢慢滴入稀盐酸,不断用玻璃棒搅拌,至溶液颜色(红色)恰好变成无色为止。
图1
分析论证 在向变红的溶液中滴入盐酸时,红色逐渐变浅,说明在加入酸的过程中酸与碱发生了反应,使溶液中的碱逐渐减少,当溶液刚好变成无色时,说明碱没有了,酸与溶液中的碱恰好完全反应。
反应微观过程如图2所示。
可以看出盐酸与NaOH溶液反应的实质是盐酸中的H+与NaOH溶液中的OH-结合成H2O分子。
反应的化学方程式为:
NaOH+HCl
NaCl+H2O。
图2
实验点拨 1.做此实验时应注意,烧杯内要先盛放氢氧化钠溶液,然后滴加酚酞试液,不要滴加石蕊试液,因为使用石蕊试液时溶液颜色变化不明显,不利于我们观察实验现象。
2.实验时用玻璃棒不断搅拌,可以使盐酸和氢氧化钠溶液充分接触,反应迅速、完全。
3.实验时用胶头滴管慢慢滴入盐酸,便于控制加入酸的量。
【例1】 下面是某小组同学学习氢氧化钠溶液和稀盐酸反应时的实录:
在盛有氢氧化钠溶液的烧杯中,插入一支温度计测量溶液的温度。
用胶头滴管吸取10%的稀盐酸逐渐加入到氢氧化钠溶液中。
(1)探究实验中的能量变化
在实验过程中,随着稀盐酸的不断滴入,溶液的温度逐渐升高,你认为溶液温度升高的原因是 。
(2)探究反应终点问题
用什么方法证明此反应已恰好完全进行?
小红说:
在实验后所得溶液中滴入几滴无色酚酞试液,若溶液颜色没有变化,则反应恰好完全进行。
小文说:
在氢氧化钠溶液中预先滴入几滴无色酚酞试液,然后再加入稀盐酸,若溶液颜色刚好变成无色,则反应恰好完全进行。
你认为他们的说法,不正确的是 ,理由是 。
(3)关于实验中的细节和意外情况:
①实验中,稀盐酸必须用胶头滴管逐滴滴加,这样做的目的是 ;
②实验过程中,要用玻璃棒不断搅拌,这样做的目的是 ;
③小凤在她的实验过程中意外发现有气泡出现,你认为原因是 。
知识点2:
中和反应
中和反应
易错警示 1.中和反应不是基本反应类型,它特指酸和碱作用生成盐和水的反应。
2.中和反应的生成物是盐和水,但生成盐和水的反应不一定是中和反应。
如金属氧化物和酸、非金属氧化物和碱也能反应生成盐和水:
Fe2O3+6HCl
2FeCl3+3H2O、2NaOH+CO2
Na2CO3+H2O,但不是中和反应。
【例2】 下列反应中,属于中和反应的是( )
A.Na2O+2HCl
2NaCl+H2O B.CO2+2NaOH
Na2CO3+H2O
C.H2SO4+2NaOH
Na2SO4+2H2O D.CO2+Ca(OH)2
CaCO3↓+H2O
知识点3:
酸、碱、盐的概念
酸、碱、盐的概念见表1。
酸
碱
盐
概念
溶于水解离出的阳离子全部是H+的化合物
溶于水解离出的阴离子全部是OH-的化合物
由金属阳离子(或N
)和酸根阴离子构成的化合物
举例
HCl、H2SO4、HNO3
NaOH、Ca(OH)2、KOH
NaCl、CaCO3、(NH4)2SO4
易错警示 溶于水解离出的阳离子(阴离子)部分是H+(OH-)的化合物不是酸(碱),可能是盐,如NaHSO4。
【例3】 物质的分类非常重要。
下列按酸、碱、盐的顺序排列的一组是( )
A.H2SO4、Na2CO3、NaCl B.Ca(OH)2、HCl、Na2SO4
C.NaOH、H2CO3、NaCl D.H2SO4、NaOH、Na2CO3
知识点4:
中和反应在实际中的应用
中和反应在实际中的应用:
易错警示 NaOH具有强烈的腐蚀性,在治疗胃酸过多和改良酸性土壤时不能使用NaOH。
拓展延伸 氢氧化铝[Al(OH)3]是一种常用的中和胃酸过多的药物,但由于反应后生成的Al3+对人体有不良作用,已逐渐被其他药物取代。
【例4】 酸与碱作用生成盐和水的反应,叫做中和反应。
它在工农业生产和日常生活中有广泛的用途。
下列应用一定与中和反应原理无关的是( )
A.施用熟石灰改良酸性土壤 B.服用含Al(OH)3的药物治疗胃酸过多
C.用熟石灰和硫酸铜配制波尔多液 D.用NaOH溶液洗涤石油产品中的残余硫酸
知识点5:
溶液酸碱度表示方法——pH
1.溶液的酸碱性
溶液的酸碱性是指溶液呈酸性、中性或碱性,可以利用酸碱指示剂来粗略测定溶液的酸碱性,却无法表示溶液酸碱性的强弱程度。
2.溶液的酸碱度
溶液的酸碱度是指定量表示溶液酸碱性强弱程度的一种方法,常用pH表示。
3.pH与酸碱性的关系
pH的范围通常在0~14之间,如图3所示:
图3
(1)酸性溶液的pH<7, pH越小,酸性越强。
(2)中性溶液的pH=7。
(3)碱性溶液的pH>7,pH越大,碱性越强。
易错警示 1.pH表示溶液酸碱性的强弱程度,但不能确定是酸的溶液或碱的溶液。
2.溶液呈酸性不一定是酸的溶液,如NaHSO4是盐,但其溶液呈酸性。
3.溶液呈碱性不一定是碱的溶液,如Na2CO3是盐,但其溶液呈碱性。
拓展延伸 pH是溶液中所含H+的浓度大小的一种表示方法。
pH<7时,溶液中H+浓度越大,酸性越强,pH越小;pH>7时,OH-的浓度越大,则碱性越强,pH越大;当溶液中H+浓度与OH-浓度相等时,则溶液的pH=7,呈中性。
【例5】 下列为常见水果的pH,呈碱性的是( )
A.柿子pH=8.5 B.菠萝pH=5.1 C.苹果pH=4.1 D.杨梅pH=2.5
知识点6:
pH的测定方法
1.测定溶液的pH最简便的方法是使用pH试纸。
2.测定方法:
在白瓷板或玻璃片上放一小片pH试纸,将被测液滴到pH试纸上,把试纸显示的颜色与标准比色卡比较,即可得到溶液的pH。
巧记速记 一放纸、二滴纸、三比对、四记录。
易错警示 1.不能直接将pH试纸浸入待测的溶液中,因为将试纸直接浸入待测液会使待测液受到污染。
2.不能先用蒸馏水将pH试纸润湿,再向试纸上滴待测液。
如果将试纸先用蒸馏水润湿,则溶液就被稀释了,测得的pH可能就不准确。
3.用广泛pH试纸测溶液的pH比较粗略,读数为整数,测不出带小数的数值。
4.溶液的酸碱性可用酸碱指示剂或pH试纸测定,溶液的酸碱度不能用酸碱指示剂测定,只能用pH试纸或pH计等测定。
拓展延伸 1.检验气体的酸性或碱性,可将试纸润湿再用。
2.广泛pH试纸只能粗略测定溶液酸碱度大小,若要精确测定溶液的酸碱度可用酸度计(也叫pH计)。
【例6】 下列检测某溶液pH的操作正确的是( )
A.将pH试纸投入待测液,对照标准比色卡读数
B.用干燥、洁净的玻璃棒蘸取少量待测液,沾在置于洁净表面皿的pH试纸上,半分钟内根据试纸呈现的颜色,对照标准比色卡读数
C.用玻璃棒蘸取待测液沾在用蒸馏水润湿的pH试纸上,对照标准比色卡读数
D.用玻璃棒蘸取待测液沾在pH试纸上,3分钟后对照标准比色卡读数
知识点7:
了解溶液酸碱度的实际意义
了解溶液酸碱度的实际意义:
【例7】 图4表示身边一些物质的pH,看图回答。
图4
(1)农作物一般适宜在pH为 或接近 的土壤中生长。
(2)正常雨水pH为5.6,是因为溶有CO2,某市雨水pH为4.9,此雨可称为 。
考点1:
利用中和反应和酸碱度解决日常生活和工农业生产中的实际问题
【例1】 城市中的生活用水是经自来水厂净化处理过的。
(1)除去水中不溶性杂质可采用什么方法?
(2)饮用被病菌污染的水会感染疾病,向水中通入氯气可杀死病菌。
氯气能跟水发生如下反应:
Cl2+H2O
HCl+HClO(次氯酸),使水显酸性,腐蚀金属管道。
为了使自来水厂输出水的pH约为8,输出前通常向水中加入熟石灰,写出可能发生反应的化学方程式。
考点2:
溶液的酸碱性与酸碱的化学性质综合
【例2】 有一食品包装说明书中注明防腐剂是苯甲酸(C6H5COOH),张华同学查资料得知苯甲酸的酸性比醋酸强,可用做食品防腐剂。
下列对苯甲酸性质的推测中不合理的是( )
A.苯甲酸溶液的pH小于7
B.相同浓度的苯甲酸溶液的pH比醋酸的pH大
C.苯甲酸溶液能使紫色石蕊试液变红
D.苯甲酸溶液不能使无色酚酞试液变色