西安第六中学生物学科竞赛专题讲义一生命的物质基础刘波Word文档下载推荐.docx
《西安第六中学生物学科竞赛专题讲义一生命的物质基础刘波Word文档下载推荐.docx》由会员分享,可在线阅读,更多相关《西安第六中学生物学科竞赛专题讲义一生命的物质基础刘波Word文档下载推荐.docx(21页珍藏版)》请在冰点文库上搜索。
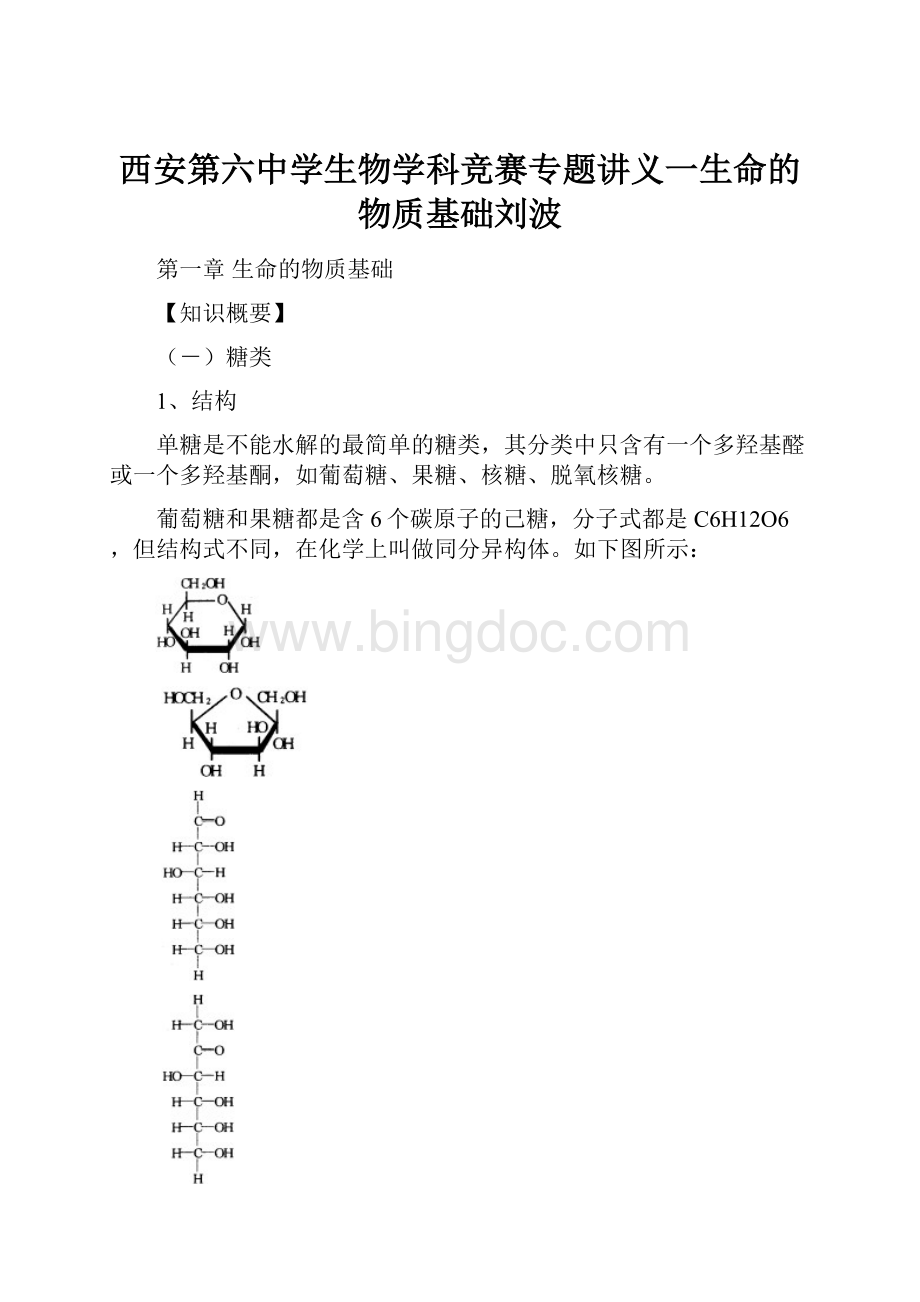
C-1称异头碳原子,所以α-和β-两种不同形式的异构体称异头物(anomer)。
二糖是由2个单糖分子脱水缩合而得的糖,以不同形式的糖苷键相连,如植物细胞内的蔗糖、麦芽糖,动物细胞内的乳糖,存在于藻类细菌、真菌和某些昆虫细胞内的海藻糖等。
蔗糖的形成见下图。
葡萄糖果糖蔗糖
多糖是由多个单糖缩聚而成链状大分子,从而构成贮藏形式的糖。
如高等植物细胞内的淀粉,高等动物细胞内的糖元,葡萄糖都是以α-1,4糖苷键9(直链)和α-1,6糖苷键(支链)相连。
纤维素是植物中最普遍的结构多糖,葡萄糖以β-1,4糖苷键相连。
2、性质
单糖和二糖一般溶于水,多糖一般不溶于水,多不溶于乙醚、丙酮等有机溶剂。
甜度:
以蔗糖为100,则果糖173,葡萄糖74,麦芽糖半乳糖32,乳糖16。
糖的甜度无疑是与其化学结构有关,必然由于糖分子中的某些原子基团对舌尖味觉神经所起的刺激而引起。
多糖无甜味,是因其分子太大,不能透入舌尖的味觉乳头细胞。
3、鉴定
还原糖常用的试剂为含Cu2+的碱性溶液,如葡萄糖、果糖、麦芽糖、核糖和乳糖含有醛基或酮基。
硫酸铜溶液与KOH(或NaOH)和酒石酸钾钠(或柠檬酸钠)配成的试剂称Fehling①试剂。
如用无水Na2CO3代替KOH或NaOH所成的试剂,则称Benedict①试剂。
酒石酸钾钠或柠檬酸钠的作用是防止反应产生的氢氧化铜或碳酸铜沉淀,使之变为可溶性的而又略能离解的复合物,从而保证继续供给Cu2+以氧化糖。
碱的作用为使糖起烯醇化变为强还原剂,同时使硫酸铜变为Cu(OH)2。
蔗糖无还原作用,因结合成二糖时醛基与酮基的特性都已完全丧失。
酮糖(如果糖)能更快在盐酸下脱水成糠醛衍生物,与间-苯二酚(Seliwanoff试验)缩合形成红色复合物,而醛糖(如葡萄糖)颜色稍浅。
戊糖(如核糖)被浓HCl脱水产生的呋喃醛与间苯二酚作用生成绿色溶液或绿色沉淀(Bial试验)。
直链淀粉与支链淀粉皆与碘作用而显色。
直链淀粉与碘作用呈蓝色,支链淀粉与碘作用则呈紫红色。
淀粉水解后产生的红色糊精与碘作用呈红色,无色糊精与碘作用不显色。
功能:
能源,分解提供能量;
碳源,转化其他化合物提供碳链;
结构,纤维素植物细胞壁,壳多糖昆虫外骨骼,肽聚糖细菌细胞壁;
储能,淀粉和糖元;
识别,糖被;
润滑,黏膜分泌黏液的黏多糖。
(二)蛋白质
所有蛋白质的元素组成都很近似,都含有C、H、O、N四种元素,其中平均含氮量约占16%。
1.蛋白质的基本组成单位——氨基酸
组成蛋白质的氨基酸有20种,主要是α型氨基酸,其中19种结构可用通式表示。
脯氨酸侧链与氮原子相接形成亚氨基酸除外,形成肽链时只能位于N端。
除甘氨酸外,蛋白质中的氨基酸都具有不对称碳原子,都有L—型与D一型之分。
已知天然蛋白质中的氨基酸都属L型。
根据R基来区分的,氨基酸分为脂肪族、芳香族和杂环族三类。
根据极性(分子内部正电中心与负电中心不重叠而产生的)通常分为4类:
(1)非极性(疏水),有:
甘氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、苯丙氨酸、甲硫氨酸、脯氨酸、色氨酸;
(2)极性(亲水),不带电荷,有:
丝氨酸、苏氨酸、天冬酰胺、谷氨酰胺、酪氨酸、半胱氨酸;
(3)极性(亲水),带负电荷,有:
天冬氨酸、谷氨酸;
(4)极性(亲水),带正电荷,有:
组氨酸、赖氨酸、精氨酸。
氨基酸由于含有氨基和羧基,因此在化学性质上表现为是的一种兼有弱碱和弱酸的两性化合物。
对于含有一个氨基和一个羧基的α–氨基酸来说,在中性溶液中或固体状态下,是以中性分子的形式还是以两性离子的式存在呢?
许多实验证明主要是以两性离子的形式存在。
中性分子形式两性离子形式
氨基酸在溶液中的带电状态,会随着溶液的pH值而变化,如果氨基酸的净电荷等于零,在外加电场中不发生向正极或负极移动的现象,在这种状态下溶液的pH值称为其等电点,常用pI表示。
由于各种氨基酸都有特定的等电点,因此当溶液的pH值低于某氨基酸的等电点时,则该氨基酸带净正电荷,在电场中向阴极移动。
若溶液的pH值高于某氨基酸的等电点时,则该氨基酸带净负电荷,在电场中向阳极移动。
氨基酸等电点的计算方法:
对于单氨基单羧基的氨基酸,其等电点是pK1和Pk2的算术平均值,即从pI=1/2(pK1+pK2)公式中求得;
对于含有3个可解离基团的氨基酸来说,只要依次写出它从酸性经过中性至碱性过程中的各种离子形式,然后取两性离子两侧的pK值的算术平均值,即可得其pI值。
例如Asp解离时,有3个pK值,在不同pH条件下可以有4种离子形式,如下图所示。
在等电点时,两性离子形式主要是Asp+,因此Asp的pI=1/2(pK1+pK2)=1/2(2.09+3.86)=2.98。
同样方法可以求得其他含有3个pK值的氨基酸的等电点。
分子呈酸性有天门冬氨酸2.97和谷氨酸3.22,分子呈碱性有精氨酸10.76和赖氨酸9.74,其他分子近中性6。
可以利用各种氨基酸等电点的不同,电泳分离氨基酸。
各种氨基酸在可见光区都没有光吸收,而在紫外光区仅色氨酸、酪氨酸和苯丙氨酸有吸收能力。
其中色氨酸的最大吸收波长为279nm,酪氨酸的最大吸收波长为278nm,苯丙氨酸的为259nm。
利用紫外光法可以测定这些氨基酸的含量。
蛋白质在280nm的紫外光吸收绝大部分是由色氨酸和酪氨酸所引起的。
因此测定蛋白质含量时,用紫外分光光度法测定蛋白质在280nm的光吸收值是一种既简便而又快速的方法。
氨基酸的氨基特异反应是茚三酮反应,除脯氨酸与茚三酮反应显黄色,其他均显紫色。
2.蛋白质的化学结构与空间结构
蛋白质的一级结构:
又称初级结构或化学结构,是指组成蛋质分子的多肽链中氨基酸的数目、种类和排列顺序,多肽链的数目,同时也包括链内或键间二硫键的数目和位置等。
蛋白质分子的一级结构是由共价键形成的,肽键和二硫键都属于共价键。
肽键是蛋白质分子中氨基酸连接的基本方式,形成共价主链。
二硫键(—S—S)是由两个半胱氨酸(残基)脱氢连接而成的,是连接肽链内或肽链间的主要化学键。
二硫键在蛋白质分子中起着稳定肽链空间结构的作用,往往与生物活力有关。
二硫键被破坏后,蛋白质或多肽的生物活力就会丧失。
蛋白质结构中,二硫键的数目多,蛋白质结构的稳定性就越强。
在生物体内起保护作用的皮、角、毛发的蛋白质中,二硫键最多。
蛋白质的二级结构:
是指多肽链本身折叠和盘绕方式,是指蛋白质分子中的肽链向单一方向卷曲而形成的有周期性重复的主体结构或构象。
这种周期性的结构是以肽链内或各肽链间的氢键来维持。
常见的二级结构有α–螺旋、β–折叠、β–转角等。
例如动物的各种纤维蛋白,它们的分子围绕一个纵轴缠绕成螺旋状,称为α–螺旋。
相邻的螺旋以氢键相连,以保持构象的稳定。
指甲、毛发以及有蹄类的蹄、角、羊毛等的成分都是呈α–螺旋的纤维蛋白,又称α–角蛋白。
β–折叠片是并列的比α–螺旋更为伸展的肽链,互相以氢铸连接起来而成为片层状,如蚕丝、蛛丝中的β–角蛋白。
蛋白质的三级结构:
是指在二级结构的基础上,进一步卷曲折叠,构成一个很不规则的具有特定构象的蛋白质分子。
维持三级结构的作用力主要是一些所谓弱的相互作用,即次级键或称非共价键,包括氢键、盐键、疏水键和范德华力等。
盐键又称离子健,是蛋白质分子中正、负电荷的侧链基团互相接近,通过静电吸引而形成的,如羧基和氨基、胍基、咪唑基等基团之间的作用力。
疏水键是多肽链上的某些氨基酸的疏水基团或疏水侧链(非极性侧链)由于避开水而造成相互接近、粘附聚集在一起。
它在维持蛋白质三级结构方面占有突出地位。
范德华引力是分子之间的吸引力。
此外二硫键也对三级结构的构象起稳定作用。
酶、多种蛋白质激素、各种抗体以及细胞质和细胞膜中的蛋白质都是球蛋白。
球蛋白的表面富有亲水基团,因此都能溶于水。
蛋白质的四级结构:
是由两条或两条以上的具有三级结构的多肽聚合而成特定构象的蛋白质分子。
构成功能单位的各条肽链,称为亚基,一般地说,亚基单独存在时没有生物活力,只有聚合成四级结构才具有完整的生物活性。
例如,磷酸化酶是由2个亚基构成的,谷氨酸脱氢酶是由6个相同的亚基构成的,血红蛋白是由4个不同的亚基(2个α肽链,2个β链)构成的,每个链都是一个具三级结构的球蛋白。
亚基聚合成四级结构,是通过分子表面的一些次级键,主要是盐键和氢键结合而联系在一起的。
有些蛋白质分子只有一、二、三级结构,并无四级结构,如肌红蛋白、细胞色素C、核糖核酸酶、溶菌酶等。
另一些蛋白质,则一、二、三、四级结构同时存在,如血红蛋白、过氧化氢酶、谷氨酸脱氢酶等。
3.蛋白质的性质及生物学功能
(1)胶体性质:
蛋白质分子量很大,容易在水中形成胶体粒,具有胶体性质。
在水溶液中,蛋白质形成亲水胶体,就是在胶体颗粒之外包含有一层水膜。
水膜可以把各个颗粒相互隔开,所以颗粒不会凝聚成块而下沉。
(2)沉淀作用:
高浓度中性盐驱除蛋白质表面的水化膜,金属离子与蛋白质结合成蛋白盐,PH调至蛋白质等电点,都可以降低蛋白质与水的亲和力而沉淀。
由于沉淀蛋白质空间结构未变,仍具有生物活性,所以常用于分离蛋白质。
(3)变构作用:
含2个以上亚基的蛋白质分子,如果其中一个亚基与小分子物质结合,那就不但该亚基的空间结构要发生变化,其他亚基的构象也将发生变化,结果整个蛋白质分子的构象乃至活性均将发生变化,这一现象称为变构或别构作用。
例如,某些酶分子可以和它所催化的最终产物结合,引起变构效应,使酶的活力降低,从而起到反馈抑制的效果。
但是结合物褪下后,空间结构可以恢复。
(4)变性作用:
蛋白质在重金属盐(汞盐、银盐、铜盐等)、酸、碱、乙醛、尿素等的存在下,或是加热至70~100℃,或在X射线、紫外线的作用下,其空间结构发生改变和破坏,从而失去生物学活性,这种现象称为变性。
变性过程中不发生肽键断裂和二硫键的破坏,因而不发生一级结构的破坏,而主要发生氢键、疏水键的破坏,使肽链的有序的卷曲、折叠状态变为松散无序,空间结构不可以恢复。
变性蛋白分子相互缠绕即会出现凝固现象。
蛋白质具有多种多样的生物学功能,归纳起来主要具有5个方。
蛋白质是一切生命现象不可缺少的,即使像病毒、类病毒那样以核酸为主体的生物,也必须在它们寄生的活细胞的蛋白质的作用下,才能表现出生命现象。
(三)核酸
1.核酸的基本单位——核苷酸
每一个核苷酸分子由一分子戊糖(核糖或脱氧核糖)、一分子磷酸和一分子含氮碱基组成。
碱基分为两类:
一类是嘌呤,为双环分子;
另一类是嘧啶,为单环分子。
嘌呤一般均有A、G2种,嘧啶一般有C、T、U3种,有共轭双键。
在一些核酸中还存在少量其他修饰碱基。
由于含量很少,故又称微量碱基或稀有碱基。
核酸中修饰碱基多是4种主要碱基的衍生物。
tRNA中的修饰碱基种类较多,如次黄嘌呤、二氢尿嘧啶、5–甲基尿嘧啶、4–硫尿嘧啶等。
5’﹣腺嘌呤核苷酸(5’﹣AMP)
DNA的碱基有四种(A、T、G、C),RNA的碱基也有四种(A、U、G、C)。
腺嘌呤(A)鸟嘌呤(G)胸腺嘧啶(T)尿嘧啶(U)胞嘧啶(C)
2.核酸的化学结构
核酸分DNA和RNA两大类。
所有生物细胞都含有这两大类核酸(病毒只含有DNA或RNA)。
核酸分子是由核苷酸单体通过3’,5’–磷酸二酯键聚合而成的多核苷酸长链。
核苷酸单体之间是通过脱水缩合而成为聚合物的,这点与蛋白质的肽链形成很相似。
在脱水缩合过程中,一个核苷酸中的磷酸给出一个氢原子;
另一个相邻核苷酸中的戊糖给出一个羟基,产生一分子水,每个单体便以磷酸二酯键的形式连接起来。
由许多个核苷酸缩合而形成多核苷酸链。
如果用脾磷酸二酯酶来水解多核苷酸链,得到的是3’–核苷酸,而用蛇毒磷酸二酯酶来水解得到的却是5’–核苷酸。
这证明多核苷酸链是有方向的,一端叫3’–未端,一端叫5’–末端。
所谓3’–末端是指多核苷酸链的戊糖上具有3’–磷酸基(或羟基)的末端,而具有5’–磷酸基(或羟基)的末端则称为5’末–端。
多核苷酸链两端的核苷酸为末端核苷酸,末端磷酸基与核苷相连的键称为磷酸单酯键。
通常寡核苷酸链可用右面的简式表示(如右图所示)。
细胞生物DNA的二级结构是由两条反向平行的多核苷酸链绕同一中心轴构成双螺旋结构。
RNA通常以核苷酸单链存在,有信使、核糖体、转运RNA三种。
3.核酸的性质
(1)一般性质
核酸和核苷酸既有磷酸基,又有碱性基团,为两性电解质,因磷酸的酸性强,通常表现为酸性。
核酸可被酸、碱或酶水解成为各种组分,其水解程度因水解条件而异。
RNA在室温条件下被稀碱水解成核苷酸而DNA对碱较稳定,常利用该性质测定RNA的碱基组成或除去溶液中的RNA杂质。
DNA为白色纤维状固体,RNA为白色粉末;
都微溶于水,不溶于一般有机溶剂。
常用乙醇从溶液中沉淀核酸。
(2)核酸的紫外吸收性质
核酸中的嘌呤碱和嘧啶碱均具有共轭双键,使碱基、核苷、核苷酸和核酸在240~290nm的紫外波段有一个强烈的吸收峰,最大吸收值在260nm附近。
不同的核苷酸有不同的吸收特性。
由于蛋白质在这一光区仅有很弱的吸收,蛋白质的最大吸收值在280nm处,利用这一特性可以鉴别核酸纯度及其制剂中的蛋白质杂质。
(3)核酸的变性和复性
①核酸的变性:
是指核酸双螺旋区的氢键断裂,碱基有规律的堆积被破坏,双螺旋松散,发生从螺旋到单键线团的转变,并分离成两条缠绕的无定形的多核苷酸单键的过程。
变性主要是由二级结构的改变引起的,因不涉及共价键的断裂,故一级结构并不发生破坏。
多核苷酸骨架上共价键(3’,5’—磷酸二酯健)的断裂称为核酸的降解,降解引起核酸分子量降低。
引起核酸变性的因素很多,如加热引起热变性,pH值过低(如pH<4=的酸变性和pH值过高(pH>11.5)的碱变性,纯水条件下引起的变性以及各种变性试剂,如甲醇、乙醇、尿素等都能使核酸变性。
此外,DNA的变性还与其分子本身的稳定性有关,由于C—C中有三对氢健而A-T对只有两对氢键,故C+G百分含量高的DNA分子就较稳定,当DNA分子中A+T百分含量高时就容易变性。
环状DNA分子比线形DNA要稳定,因此线状DNA较环状DNA容易变性。
核酸变性后,一系列物理和化学性质也随之发生改变,如260nm区紫外吸收值升高,粘度下降,浮力密度升高,同时改变二级结构,有的可以失去部分或全部生物活性。
DNA的加热变性一般在较窄的温度范围内发生,很像固体结晶物质在其熔点突然熔化的情况,因此通常把热变性温度称为“熔点”或解键温度,用Tm表示。
对DNA而言,通常把DNA的双螺旋结构失去一半时的温度(或变性量达最大值的一半时的温度)称为该DNA的熔点或解链温度。
DNA的Tm值一般在70℃~85℃。
RNA变性时发生与DNA变性时类似的变化,但其变化程度不及DNA大,因为RNA分子中只有部分螺旋区。
②核酸的复性:
变性DNA在适当条件下,又可使两条彼此分开的链重新缔合成为双螺旋结构,这个过程称为复性。
DNA复性后,许多物理、化学性质又得到恢复,生物活性也可以得到部分恢复。
DNA的片段越大,复性越慢;
DNA的浓度越高,复性越快。
在生物体内,核苷酸除了作为核酸的基本组成单位外,还有一些核苷酸类物质自由存在于细胞内,具有各种重要的生理功能。
(1)含高能磷酸基的ATP类化合物:
5’–腺苷酸进一步磷酸化,可以形成腺苷二磷酸和腺苷三磷酸,分别为ADP和ATP表示。
ADP是在AMP接上一分子磷酸而成,ATP是由AMP接上一分子焦磷酸(PPi)而成,它们的结构式如下图所示。
腺苷二磷酸(ADP)腺苷三磷酸(ATP)
这类化合物中磷酸之间是以酸酐形式结合成键,磷酸酐键具有很高的水解自由能,习惯上称为高能键,通常用“~”表示。
ATP分子中有2个磷酸酐键,ADP中只含1个磷酸酐键。
在生活细胞中,ATP和ADP通常以Mg2+或Mn2+盐的复合物形式存在。
特别是ATP分子上的焦磷酸基对二价阳离子有高亲和力;
加上细胞内常常有相当高浓度的Mg2+,使ATP对Mg2+的亲和力远大于ADP。
在体内,凡是有ATP参与的酶反应中,大多数的ATP是以Mg2+—ATP复合物的活性形式起作用的。
当ATP被水解时,有两种结果:
一是水解形成ADP和无机磷酸;
另一种是水解生成AMP和焦磷酸。
ATP是大多数生物细胞中能量的直接供体,ATP-ADP循环是生物体系中能量交换的基本方式。
在生物细胞内除了ATP和ADP外,还有其他的5’–核苷二磷酸和三磷酸,如GDP、CDP、UDP和GTP、CTP、UTP;
5’–脱氧核苷二磷酸和三磷酸,如dADP、dGDP、dTDP、dCDP和dATP、dCTP、dGTP、dTTP,是DNA合成所必需的原材料。
(2)环状核苷酸;
核苷酸可在环化酶的催化下生成环式的一磷酸核苷。
其中以3’,5’–环状腺苷酸(以cAMP)研究最多,它是由腺苷酸上磷酸与核糖3’,5’碳原子酯化而形成的,它的结构式如下图所示。
正常细胞中cAMP的浓度很低。
在细胞膜上的腺苷酸环化酶和Mg2+存在下,可催化细胞中ATP分子脱去一个焦磷酸而环化成cAMP,使cAMP的浓度升高,但cAMP又可被细胞内特异性的磷酸二酯酶水解成5’–AMP,故cAMP的浓度受这两种酶活力的控制,使其维持一定的浓度。
该过程可简单表示如下:
ATP
cAMP+焦磷酸
5’–AMP
现认为cAMP是生物体内的基本调节物质。
它传递细胞外的信号,起着某些激素的“第二信使”作用。
不少激素的作用是通过cAMP进行的,当激素与膜上受体结合后,活化了腺苷酸环化酶,使细胞内的cAMP含量增加。
再通过cAMP去激活特异性的蛋白激酶,由激酶再进一步起作用。
近年来发现3’、5’–环鸟苷酸(cGMP)也有调节作用,但其作用与cAMP正好相拮抗。
它们共同调节着细胞的生长和发育等过程。
(四)脂质
(l)脂肪也叫中性脂,一种脂肪分子是由一个甘油分子中的三个羟基分别与三个脂肪酸的末端羟基脱水连成酯键形成的。
脂肪是动植物细胞中的贮能物质,当动物体内直接能源过剩时,首先转化成糖元,然后转化成脂肪。
在植物体内就主要转化成淀粉,有的也能转化成脂肪。
甘油三酯中脂肪酸有饱和和不饱和、链长和链短之分,饱和和链长脂肪酸越多,熔点越高,比如动物脂30度、植物油3度左右。
脂肪分子中含碳氢较糖类多,所以氧化分解时产热大。
1克脂肪释放38.91千焦,1克糖类释放17.15千焦,大一倍多。
同时脂肪分子中含氧少,氧化分解时耗氧多。
油料种子种植时,埋在土中要稍浅一点。
(2)类脂包括磷脂和糖脂,这两者除了包含醇、脂肪酸外,还包含磷酸、糖类等非脂性成分。
含磷酸的脂类衍生物叫做磷酯,含糖的脂类衍生物叫做糖脂。
磷脂和糖脂都参与细胞结构特别是膜结构的形成,是脂类中的结构大分子。
(3)固醇又叫甾醇,是含有四个碳环和一个羟基的烃类衍生物,是合成胆汁及某些激素的前体,如肾上腺皮质激素、性激素。
有的固醇类化合物在紫外线作用下会变成维生素D。
在人和动物体内常见的固醇为胆固醇。
(五)水
水分子极性强,把许多物质解离成离子;
流动性大利于运输物质;
热容大,吸收大量热而自身温度升高不大;
蒸发热大利于降温。
当自由水比例升高,生物代谢加快,生长迅速。
当自由水向结合水转化,抗旱、抗热、抗寒的性能提高。
(六)无机盐
各种无机盐离子在体液中的浓度是相对稳定的,其主要作用有:
维持渗透压平衡,影响水分的渗透;
维持酸碱平衡,如HPO42-、H2PO4-和HCO3-、CO32-;
维持离子平衡,Na+细胞外高于内,K+细胞内高于外。
(七)维生素
分脂溶性A、D、E、K,作用分别是夜盲、佝偻、不育、出血不止;
水溶性B1、B2、B6、B12、C等,作用分别是脚气、口角炎、皮炎、红细胞贫血、坏血症。
维生素是酶的辅助结构,影响生物的新陈代谢。
5’﹣腺瞟吟核苷酸(5’﹣AMP)
【解题指导】
例2肾上腺皮质细胞产生的激素其结构与以下哪一种物质结构相似?
A血红蛋白B胆固醇C酪氨酸D肾上腺素
析激素依化学成分分成两类,一类是由肾上腺皮质分泌的激素统称肾上腺皮质激素,属于类固醇激素;
另一类属于含氮物质激素,包括蛋白质、多肽(胰岛素、甲状分腺素)和胺类(肾上腺素、甲状腺激素)。
上题中胆固醇是一种固醇类化合物,所以肾上腺皮质分泌的激素与胆固醇的结构相似。
答案选B。
例1请用最简便的方法,鉴别核糖、葡萄糖、果糖、蔗糖和淀粉。
分析鉴别核糖、葡萄糖、果糖、蔗糖和淀粉最简便的方法是显色法。
首先在这五种糖中各加入适量碘液,只有淀粉变蓝色,其余四糖不变色。
然后在除淀粉外的四糖中分别加适量的盐酸和间苯二酚,核糖呈绿色,葡萄糖呈淡红色,果糖呈红色,而蔗糖不变色。
这一下可鉴别出核糖和蔗糖。
再在葡萄糖和果糖中分别加入几滴溴水,由于葡萄糖具有还原性而使溴水褪色,果糖无还原性,不能使溴水褪色,从而就能达到区分这两种糖的目的。
例2根据蛋白质的有关知识回答下列问题:
(1)氨基酸的极性由什么决定?
组成蛋白质的20种氨基酸中具有极性的氨基酸有多少种?
(2)组成蛋白质的氨基酸中,哪一种不能参与形成真正的肽键?
为什么。
(3)什么是蛋白质的等电点(pI)?
为什么说在等电点时蛋白质的溶解度最低?
分析
(1)氨基酸的极性由其侧链基团(R)决定,组成蛋白质的20种氨基酸中具有极性的氨基酸有11种。
(2)组成蛋白质的氨基酸中,脯氨酸(Pro